下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
(1)甲、乙、丙三个装置中共同发生的化学方程式是 。
(2)和甲装置相比,乙装置的优点是可以控制反应的开始与停止,还可以 。
(3)为了进一步验证NO2和水的反应,当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的 水进人②试管,应如何操作?
实验室通常用右图所示的装置来制取氨气。回答下列问题:

(1)安装仪器时要求试管口略低于试管底的原因是
(2)加热后将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是
(3)除氨气外,还可以用该装置制取的常见气体有
根据下图装置进行实验,已知:Na2O2与H2O和CO2都能反应并生成O2,但与NH3不反应
回答下列问题:。
(1)在受热的试管A中NH4HCO3发生反应的化学方程式为: 。
(2)被加热的铂丝处发生的化学方程式为:___________________________________。
(3)B中出现的现象为:___________________________________________________。
(4)烧杯C中发生的现象为________________________________________________。
(5)倒置漏斗的作用 。
制取氨气并完成喷泉实验
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要制取干燥的氨气可选用 做干燥剂。
(3)如图进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是 ,该实验的原理是
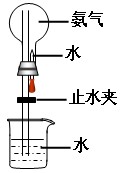
(4)反应后,烧瓶内的溶液中含有的微粒为 。
某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是 (填序号,下同)。
| A.将氯化铵固体加热分解 |
| B.将浓氨水滴入氢氧化钠固体中 |
| C.将氢氧化钠固体加入浓氨水中 |
| D.将氯化铵稀溶液滴入氢氧化钠固体中 |
(2)如图是甲同学设计收集氨气的几种装置,其中可行的是 ,集气的原理是 。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是:________,该装置中发生反应的化学方程式为________________________。
(2)实验过程中,装置乙、丙中出现的现象分别是________ ;_____________ 装置丙中的试管内发生反应的离子方程式为_______ 。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体;通入的这种气体的名称是________。
某化学兴趣小组为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质:
(1)写出甲中反应的离子方程式:_________________________________,
乙中的现象是_________________________________________________,
可证明NO2的氧化性;在丙中鼓入空气后的现象是_______________,可证明NO的还原性。
(2)实验前丙中充满水的作用是___________________________________
(用反应的化学方程式和简要文字回答)。
(3)小华对上述实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是___________________________________________。
你认为怎样才能准确证明NO2的氧化性?____________________________________(简要回答出原理和现象即可)。
氨气具有广泛的用途。
(1)工业上合成氨反应的化学方程式是 。
(2)实验室常用如下图所示装置制取并收集氨气。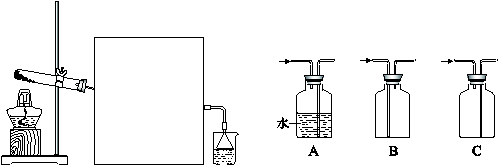
①实验室制取氨气反应的化学方程式是 。
②图中方框内收集氨气的装置可选用 (填字母序号)。
③尾气处理装置中使用倒扣漏斗的作用是 。
(3)工业上用NH3制取NO反应的化学方程式是 。
常见的化肥有氨水、NH4Cl、NH4HCO3、(NH4)2SO4、K2CO3、尿素[CO(NH2)2]等。为确定某种化肥的组成,进行下列实验:
①取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体。此气体为 ,证明化肥中含 离子(填写离子符号)。
②向上述反应后的溶液中注入过量盐酸,生成的无色无味气体可使澄清石灰水变浑浊。此气体为 ,证明化肥中含有 或 离子(填写离子符号)。
③另取少量化肥溶于水,加入CaCl2溶液无明显反应现象。由上可知该化肥的化学式为 。
下列制备和收集气体的实验装置合理的是
| A.装置①:用氯化铵和氢氧化钙制NH3 | B.装置②:用铜和稀硝酸制NO |
| C.装置③:用锌粒和稀硫酸制H2 | D.装置④:用双氧水和二氧化锰制O2 |
氨气具有还原性。在一定条件下,氨气可与氧化铜反应,反应后得到三种物质,其中有两种单质,下图为氨气与氧化铜反应并验证部分产物的装置(夹持装置略):
请回答下列问题:
(1)实验室制取氨气的化学方程式是 。
(2)能证明氨气具有还原性的现象是 ;
B装置的作用是 。
(3)A中反应的化学方程式是 。
用下图所示实验装置进行相应实验,能达到实验目的的是
| A.制氨气时,用装置①吸收尾气 |
| B.按装置②所示的气流方向收集NH3等 |
| C.用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| D.用图④所示装置分离CCl4萃取碘水后的混合液 |
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验。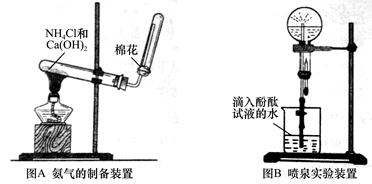
(1)根据图A写出实验室制取氨气的化学方程式_________________________;
如何检验氨气已经收集满 。
(2)甲同学用干燥的圆底烧瓶收集一瓶氨气,根据图B进行实验,观察到的实验现象是______________________________________________。根据实验现象说明氨气具有的性质是_____________________________________。
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中试管内盛放的物质是Ca(OH)2、NH4Cl固体。
【实验探究】
(1)A中发生反应的化学方程式为 。
(2)B中盛放的干燥剂为 ,干燥氨气能否用浓硫酸 (填“能”或“不能”)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L
(4)实验室收集氨气的方法是 。
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”),红色石蕊试纸变成 色。
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是 。
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
(15分)铁、铜等金属及其化合物在日常生产生活中用途非常广泛。
Ⅰ.实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu Cu(NO3)2
Cu(NO3)2
乙:Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
(1)从绿色化学的角度分析, 同学的方案更合理。
(2)乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择 装置(填字母序号)。
Ⅱ.某化学实验小组通过实验来探究一包黑色粉是否由Fe3O4、CuO组成
探究过程如下:
(1)提出假设:假设1. 黑色粉末是CuO;
假设2. 黑色粉末是Fe3O4;
假设3. 黑色粉末是CuO和Fe3O4的混合物。
(2)设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是溶液显蓝色。
②若假设2或3成立,则实验现象是 。
为进一步探究,继续向所得溶液加入足量铁粉,若产生 的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若假设3成立,则产生 现象。
III.由Fe3O4、FeO、CuO、Fe组成的固体混合物,在加热条件下用足量的CO还原,得到金属混合物2.86g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀。固体混合物的质量是 。