(15分)铁、铜等金属及其化合物在日常生产生活中用途非常广泛。
Ⅰ.实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu Cu(NO3)2
Cu(NO3)2
乙:Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
(1)从绿色化学的角度分析, 同学的方案更合理。
(2)乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择 装置(填字母序号)。
Ⅱ.某化学实验小组通过实验来探究一包黑色粉是否由Fe3O4、CuO组成
探究过程如下:
(1)提出假设:假设1. 黑色粉末是CuO;
假设2. 黑色粉末是Fe3O4;
假设3. 黑色粉末是CuO和Fe3O4的混合物。
(2)设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是溶液显蓝色。
②若假设2或3成立,则实验现象是 。
为进一步探究,继续向所得溶液加入足量铁粉,若产生 的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若假设3成立,则产生 现象。
III.由Fe3O4、FeO、CuO、Fe组成的固体混合物,在加热条件下用足量的CO还原,得到金属混合物2.86g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀。固体混合物的质量是 。
(16分)某化学兴趣小组欲设计使用如下装置验证:铜和一定量的浓硝酸反应有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
试回答下列问题:
(1)将铜粉分散在石棉绒中的原因是________________________________;
(2)在铜和浓硝酸反应前,挤压打气球,经A、B、C反应后,进入D中的气体是__ _(填化学式),通入该气体的目的是____________________ ; 进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
(3)若C装置的硬质玻璃管中出现堵塞,则B中可能出现的现象是___________________ ;
(4)关闭k1、k2,打开k3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:_________ ;
(5)若E中出现倒吸,可采取的应急操作是_________________________ ;
(6)从E装置所得溶液中取出25.00mL,加两滴酚酞,用0.1000 mol/L的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,若实验测得F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应______ (填“有”或“无”)NO生成。
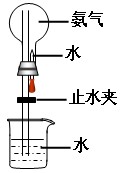
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。 

(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法。
(3)要得到干燥的氨气可选用下列 做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发水上
喷的操作是 。该实验的原理是 。
(5)如果只提供如图2的装置,请举例说明引发喷泉法 。
(8分,每空2分)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(1)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
①装置Ⅰ中制取氨气 的化学方程式为 。
的化学方程式为 。
②装置Ⅲ、Ⅳ中的实验现象分别是:黑色CuO变为红色;白色无 水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。
水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。
请写出氨气与CuO反 应的化学方程式
应的化学方程式  ;
;
③装置Ⅱ中碱石灰的作用是 。
(2)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu2O+2H+=" Cu" + Cu2+ +2H2O)。
请你设计一个简单的实验检验该红色物质中是否含有Cu2O。 
。
氨在人类的生产和生活中有着广泛的应用.某化学兴趣小组利用图一装置探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用 (填序号).B的作用是 .
a.碱石灰 b.生石灰 c.浓硫酸 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 .该反应证明氨气具有 性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成1L溶液,所得溶液的物质的量浓度为_______mol/L.
实验室用下图所示装置,通过氯化铵固体与熟石灰固体反应来制取NH3,再和CuO反应制得N2,同时还原CuO得Cu。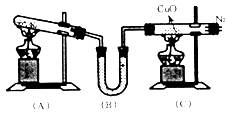
(1)写出(A)中反应的化学方程式:
(2)写出(C)中反应的化学方程式: ,在此反应中NH3表现出 性。
(3)装置(B)中装有 药品,作用是 。
(4)停止反应时,应先撤离 装置中的酒精灯。
(5)从(C)装置出来 的气体中可能含有 气体,若要获得较纯的N2,应采用 方法收集。
的气体中可能含有 气体,若要获得较纯的N2,应采用 方法收集。
(15分)某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应.其中D为纯净干燥的氯气与纯净干燥氨气反应的装置.
请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是__________________
(2)装置E的作用是____________,橡胶管k的作用是________________________
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是__________________
(4)装置F中试管内发生反应的化学方程式____________________________________
(5)接入D装置的两根导管左边较长、右边较短,目的是______________________________
(6)整套装置从左向右的连接顺序是(j)接( ) ( )接(f) (g)接( ) ( )接( ) ( )接(a).
(1)实验室常用氯化铵固体跟氢氧化钙粉末混合加热制取氨气,该反应的化 学方程式为 ;
学方程式为 ;
(2)实验室制取氨气时应用的发生装置是下图中的 (填标号),收集装置是
(填标号),选用该收集装置而不用图中另外两个收集装置的原因是 。
(3)实验室可用C装置制取的气体是 (任答一种),该反应的化学方程式为 。
制取氨气并完成喷泉实验
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要制取干燥的氨气可选用 做干燥剂。
(3)如图进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是 ,该实验的原理是
(4)反应后,烧瓶内的溶液中含有的微粒为 。
如下图所示装置,若将胶头滴管中的水挤入集气瓶中,请描述观察到的现象并写出有关的离子方程式。

(1)A中的现象为 ,
离子方程式 。
(2)C中的现象为 ,
离子方程式 。
(3)E中的现象为 ,
离子方程式 。
(4)G中的现象为 ,
离子方程式 。
(本题共12分)如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、锌粒、稀盐酸、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题: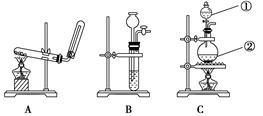
(1)选用A装置可制取的气体有________;选用B装置可制取的气体有________;通常选用C装置制取的气体有________。
(2)标号为①、②的仪器名称依次是________、______________。
(3)写出利用上述有关药品制取Cl2的离子方程式:_______________________________。
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验。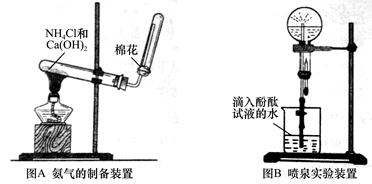
(1)根据图A写出实验室制取氨气的化学方程式_________________________;
如何检验氨气已经收集满 。
(2)甲同学用干燥的圆底烧瓶收集一瓶氨气,根据图B进行实验,观察到的实验现象是______________________________________________。根据实验现象说明氨气具有的性质是_____________________________________。
(12分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
(1)铜和浓硝酸反应的离子反应方程式是 。
(2)和甲装置相比,乙装置的优点是① ② 。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹 (填a或b或c),再打开弹簧夹 和 (填a或b或c)才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管。应如何操作 。
(本小题满分9分)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:

(1)实验1甲针筒内的现象是:有___________生成,针筒活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(2)实验2中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为____________________。
(3)实验3中,已知:3Cl2+2NH3===N2+6HCl。甲针筒处活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。