下列实验不合理的是 ( ) 
| A.证明非金属性强弱S>C>Si | B.四氯化碳萃取碘水中的碘 |
| C.制备并收集少量NO气体 | D.制备少量氧气 |
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中试管内盛放的物质是Ca(OH)2、NH4Cl固体。
【实验探究】
(1)A中发生反应的化学方程式为 。
(2)B中盛放的干燥剂为 ,干燥氨气能否用浓硫酸 (填“能”或“不能”)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L
(4)实验室收集氨气的方法是 。
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”),红色石蕊试纸变成 色。
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是 。
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
已知离子反应:Fe3++3SCN- Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应得到的氧化产物是____________(填化学式)。
(4)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意___________________________________________________.
实验室用下图所示装置进行氨气实验。

(1)试管中发生反应的化学方程式是_________________。
(2)干燥管中盛放的干燥剂是_______________(填名称)。
(3)请在方框中画出收集一烧瓶氨气的装置。
(4)检验氨气是否收集满,可选用_________试纸,实验现象是_______________。
(5)用右图装置做喷泉实验。轻轻挤压滴管,使少量水进入烧瓶,打开止水夹,观察到的现象是 ,出现这一现象的原因是 。
请完成有关氨气的问题。
(1)实验室常用下列装置和选用的试剂制取NH3,其中正确的是__________(填序号)。 
(2)若实验室收集NH3 要采用法__________。
(3)若检验NH3 ,可用__________。
常见的化肥有氨水、NH4Cl、NH4HCO3、(NH4)2SO4、K2CO3、尿素[CO(NH2)2]等。为确定某种化肥的组成,进行下列实验:
①取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体。此气体为 ,证明化肥中含 离子(填写离子符号)。
②向上述反应后的溶液中注入过量盐酸,生成的无色无味气体可使澄清石灰水变浑浊。此气体为 ,证明化肥中含有 或 离子(填写离子符号)。
③另取少量化肥溶于水,加入CaCl2溶液无明显反应现象。由上可知该化肥的化学式为 。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是________,该装置中发生反应的化学方程式为________________。
(2)实验过程中,装置乙、丙中出现的现象分别是________________;________________;装置丙中的试管内发生反应的离子方程式为________________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是______。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。
(1)氨气是重要的化工原料.实验室可用浓氨水和 来制取氨气.
a.烧碱 b.生石灰 c.氯化铵
(2)某实验小组设计了下列装置进行氨的催化氧化实验.

①盛放氨水的实验仪器的名称为 ;在加热条件下,硬质玻璃管中发生反应的化学方程式为 .
②实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因是 .
③烧杯中盛有NaOH溶液的作用是 .
(14分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
回答下列问题:
(1)A中生成氨气反应的化学方程式是_________________________________________;
(2)B中加入的干燥剂是_________(填序号)①浓硫酸②无水氯化钙 ③碱石灰;
(3)能证明氨与氧化铜反应的现象①C中______________、②D中有无色液体生成;
设计实验检验D中无色液的成分:取少量液体于试管中,加入少量________粉末,现象为_________。
(4)写出氨气与氧化铜反应的化学方程式___________________________;若收集到2.24L(STP)氮气,计算转移电子数为__________。
用下图所示实验装置进行相应实验,能达到实验目的的是
| A.制氨气时,用装置①吸收尾气 |
| B.按装置②所示的气流方向收集NH3等 |
| C.用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| D.用图④所示装置分离CCl4萃取碘水后的混合液 |
制取氨气并完成喷泉实验
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要制取干燥的氨气可选用 做干燥剂。
(3)如图进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是 ,该实验的原理是
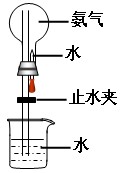
(4)反应后,烧瓶内的溶液中含有的微粒为 。
如下图所示装置,若将胶头滴管中的水挤入集气瓶中,请描述观察到的现象并写出有关的离子方程式。

(1)A中的现象为 ,
离子方程式 。
(2)C中的现象为 ,
离子方程式 。
(3)E中的现象为 ,
离子方程式 。
(4)G中的现象为 ,
离子方程式 。
(本题共12分)如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、锌粒、稀盐酸、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题: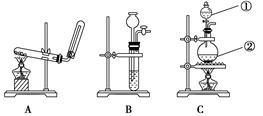
(1)选用A装置可制取的气体有________;选用B装置可制取的气体有________;通常选用C装置制取的气体有________。
(2)标号为①、②的仪器名称依次是________、______________。
(3)写出利用上述有关药品制取Cl2的离子方程式:_______________________________。
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验。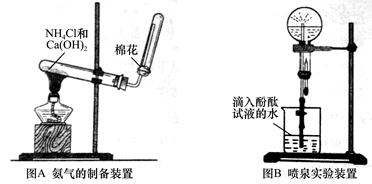
(1)根据图A写出实验室制取氨气的化学方程式_________________________;
如何检验氨气已经收集满 。
(2)甲同学用干燥的圆底烧瓶收集一瓶氨气,根据图B进行实验,观察到的实验现象是______________________________________________。根据实验现象说明氨气具有的性质是_____________________________________。
有文献记载:在强碱条件下,加热银氨溶液可能析出银镜。某同学进行如下验证和对比实验。
| 装置 |
实验序号 |
试管中的药品 |
现象 |
 |
实验Ⅰ |
2mL银氨溶液和数滴较浓NaOH溶液 |
有气泡产生;一段时间后,溶液逐渐变黑,试管壁附着银镜 |
| 实验Ⅱ |
2mL银氨溶液和 数滴浓氨水 |
有气泡产生;一段时间后,溶液无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.Ag(NH3)2++2H2O Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是 。
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。
①用湿润的红色石蕊试纸检验NH3产生的现象是 。
②产生Ag2O的原因是 。
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O。
实验及现象:向AgNO3溶液中加入 ,出现黑色沉淀;水浴加热,未出现银镜。
(4)重新假设:在NaOH存在下,可能是NH3还原Ag2O。
用下图所示装置进行实验,发现试管中出现银镜。
在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略)。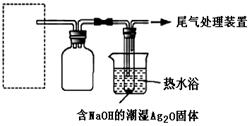
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成,由此又提出假设:在NaOH存在下,可能是 Ag(NH3)2OH也参与了NH3还原Ag2O的反应。进行如下实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是 。
②实验结果证实假设成立,依据的现象是 。
(6)用HNO3清洗试管壁上的Ag,该反应的化学方程式是 。