现有某金属硝酸盐的化学式为M(NO3)2,为了探究其热分解产物,某化学小组开展探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同。如,2KNO3 2KNO2+O2↑,
2KNO2+O2↑,
2Cu (NO3)2 2CuO+4NO2↑+O2↑, 4AgNO3
2CuO+4NO2↑+O2↑, 4AgNO3 4Ag+4NO2↑+2O2↑
4Ag+4NO2↑+2O2↑
【提出猜想】猜想1 M(NO3)2 M(NO2)2+O2↑
M(NO2)2+O2↑
猜想2 2 M(NO3)2 2MO+4NO2↑+O2↑
2MO+4NO2↑+O2↑
猜想3 。
【设计实验】为了探究上述猜想,设计如下实验装置:
【实验步骤】①连接仪器;②检查装置气密性;③取一定量样品装入大试管中,并重新连接好仪器;④加热;⑤……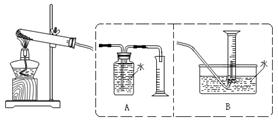
⑴写出猜想3的化学方程式: ;
⑵测定气体体积应选择 (填A或B);不选另一个装置的理由是
;
⑶实验收集到一定量气体是 ,量筒读数前应注意 ;
为了检验收集气体的成分,其操作方法是
;
⑷在实验后量筒里的水中加入适量碳酸氢钠粉末,溶液中产生大量气体,说明 正确(填“猜想1”、“猜想2”或“猜想3”);
⑸该小组测得两组数据:①实验前样品质量为Wg,收集到气体体积为V L;②实验前
样品质量为Wg,完全分解后测得固体产物质量为m g;
请你选择其中一组数据,计算元素M的相对原子质量为 。
(本题共10分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
已知:a:常见双原子单质分子中,X分子含共价键最多。
b:甲分子中含10个电子,乙分子中含有18个电子。
(1)X的结构式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备收集甲。
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填化学式)
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
。
④写出工业制甲的化学方程式 。
已知:Fe2+能被稀硝酸氧化,反应方程式为:3Fe(NO3)2+4HNO3(稀) 3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
| 硝酸体积(mL) |
100 |
200 |
300 |
400 |
| 剩余固体(g) |
18.0 |
9.6 |
0 |
0 |
| 放出气体的体积(mL) |
2240 |
4480 |
6720 |
|
(1)由NO与HNO3的关系可知,稀硝酸的物质的量浓度为_______ mol·L-1。
(2)稀硝酸的密度为__________g/cm3。
(3)放出2240 mL气体时,反应的离子方程式是_____________________________,放出4480 mL气体时,消耗金属的质量为_______g。
(4)原混合物中铁和铜的物质的量比为__________。
(5)加入400 mL稀硝酸,反应完全后,溶液中NO3-的物质的量为________mol。
(6)当溶液中Cu2+、Fe2+的物质的量浓度相等时,放出气体的体积_________mL(标准状况下)。
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)As2S3和HNO3有如下反应,As2S3+10H++ 10NO3—="2H3AsO4+" 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(3)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5mol c.大于0.5mol d.无法确定
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下 列问题:
列问题:
(1)X的化学式为___ __,D的原子结构示意图为___ __。
(2)元素的非金属性C______ E(填“>”、“<”或“=”)。
下列各项中,能说明这一结论的事实有_____ _(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)BC和BC2气体可用纯碱溶液吸收,有关化学方程式为:
2 BC2+Na2CO3=NaBC2+NaBC3+CO2↑
BC+BC2+Na2CO3=2NaBC2+CO2↑
① 配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
② 现有1000g质量分数为21.2%的纯碱吸收液,吸收BC和BC2混合气体,每产生22.4L(标准状况)CO2时,吸收液质量增加44g。
(a)计算吸收液中NaBC2和NaBC3物质的量之比。
(b)1000g质量分数为21.2%的纯碱吸收液在20℃经充分吸收BC和BC2混合气体后,蒸发掉688g水,冷却到0℃,最多可析出NaBC2多少克?(0℃时,NaBC2的溶解度为71.2g /100g水)
(14分)氮是地球上极为丰富的元素,氮元素可形成多种离子,如:N3—、N3—、NH2—、NH4+、N2H5+、N2H62+等。
(1)请画出氮的原子结构示意图___________。
(2)氮的常见氢化物的结构式为________,其空间构型为_______,它极易溶于水的主要原因是_________________,溶于水后显碱性的原因是_______________(用离子方程式说明)
(3)X+中所有电子正好充满K、L两个电子层,它与N3—形成的晶体结构如图26题 l所示。与同一个N3—相连的X+有________个,X的元素符号是________。
(4)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCI相似的晶体结构。图26题-2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是_______________。
有分别含有A、B、C、D、E、F的六瓶无色溶液,这六种溶质均是中学化学中常用的无机试剂。已知纯E为无色油状液体,溶于水时会放出大量热;B、C、D和F是常见金属的盐,且它们的阴离子均不同。现进行如下实验:
①A的溶液有刺激 性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A的溶液分别加入其它五种物质的溶液中,只有溶有D、F的溶液中有白色沉淀产生;继续加入过量A溶液时,D中沉淀无变化,F中沉淀完全溶解;
③将B的溶液分别加入C、D、E、F的溶液中,含C、D、F的三种溶液中均产生沉淀,E溶液中有无色、无味气体逸出;
④将C的溶液分别加入D、E、F中,均有白色沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,请回答下列问题:
(1)确定化学式A C . E
(2)写出F中沉淀完全溶解的化学方程式 。
(3)B在溶液中电离出的阴离子为 (填化学式),能否确定B在溶液中电离生产的阳离子?若能,写出离子符号,若不能说明进一步鉴定的方法。 。
(4)D在溶液中电离出的阴离子为 (填化学式),能否确定D在溶液中电离生产的阳离子?若能,写出离子符号,若不能说明进一步鉴定的方法。 。