HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为 Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是____________(填序号)。
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是____________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:____________________。
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是___________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是______________________。
在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系。

试计算:
(1) NaOH溶液的物质的量浓度是 mol·L-1
(2) 当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为 L(标准状况)
(3) 当NaOH溶液为180mL,固体仍为51.6g时,充分反应产生的气体为 L(标准状况)。
“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是 。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,
可能发生氧化还原反应,下列反应可能发生的是 。
A.NH4NO3 → N2 + O2 + H2O
B.NH4NO3 → NH3 + HNO3
C.NH4NO3 → O2 + HNO3 + H2O
D.NH4NO3→ N2 + HNO3 +H2O
E.NH4NO3→N2+ NH3+ H2O
F.NH4NO3 →N2O + H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
①H2O2处理法:NaCN + H2O2 —— N2↑+ X + H2O推测X的化学式为 。
② NaClO处理法:aCN-+bClO-+2cOH-= dCNO-+eN2↑+fCO32-+bCl-+cH2O
方程式中e : f的值为 (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:______________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为: .
(2)在一定体积的10mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 .
(3)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体.若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是 .
(本题共14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
① 写出该反应的化学方程式 .若反应中生成0.15 mol HNO3,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3,F2,NO三种气体中,氧化性由强到弱的顺序为
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有__________________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
I.氮及其化合物在很多方面有重要的用途。
(1)氮的氧化物有多种。现有NO和NO2的混合气体,其中N 、O元素质量之比为7:12,则该混合气中NO和NO2的物质的量之比为 。
(2)氨气的实验室制法有多种,若不加热,制取氨气所用试剂可以用浓氨水和氢氧化钠固体,产生氨气的原因是: ;氨气的检验方法是: 。

通过如图装置(尾气处理装置已略去)验证了氨有还原性,硬质玻璃管中氨发生催化氧化反应的化学方程式为_________________________。
(3)氮的一种氢化物肼(即N2H4)用作发射卫星的燃料。
已知: N2 + 2O2 = 2NO2 N2H4 + O2 = N2 + 2H2O
发射卫星用气体肼为原料,以NO2气体为氧化剂。若1 g气体肼与NO2气体反应生成氮气和水蒸气放出a kJ热量,写出反应的热化学方程式______________________。反应中生成N2质量为42g,则转移电子的物质的量为________________。
II.已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
查资料得:HNO2是一种弱酸且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是_______________(填序号)。
A.测定这两种溶液的pH B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI-淀粉溶液来区别 D.分别在两种溶液中滴加甲基橙
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是_____________(填序号)。
A.Cl2 B.H2O2 C.KMnO4 D.HNO3
(3)某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3-和Mn2+,请写出反应的离子方程式:________________。
(4)已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是______________。
在浓硝酸中放入铜片发生反应:
(1)待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是 (用离子方程式表示)
(2)若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6L(标况)。则所消耗硝酸的物质的量是 mol
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是 mol
硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措。
(1)研究发现利用NH3可消除硝酸尾气中的NO污染。NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示:
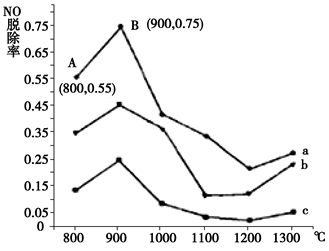
①用化学反应方程式表示NH3消除NO的反应原理 (不用注明反应条件)。
②曲线b 对应NH3与NO的物质的量之比是 。
③曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为____ mg/(m3·s)。
(2)NO、NO2混合气体能被NaOH溶液吸收生成NaNO2和NaNO3,若吸收的溶液中N的浓度为ag·L- 1,要使1m3该溶液中的完全转化为,至少需通入标准状况下的O2 L。(用含a的代数式表示,计算结果保留整数)
(3)SO2被少许NaOH溶液吸收生成能使pH试纸变红的NaHSO3溶液,工业上可电解NaHSO3得到重要化工产品Na2S2O4。
①NaHSO3溶液中离子浓度大小为 。
②写出生成S2的电极反应式 。
自然界中氮元素有多种存在形式。
(1)合成氨反应的化学方程式是_________________。
(2)NH3在一定条件下可被氧化.
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
ⅱ.
①断开1mol H-O 键与断开 1mol H-N 键所需能量相差约_________kJ;
(3)下图是某压强下,N2与H2按体积比1:3投料时,反应混合物中氨的体积分数随温度的变化曲线.其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线.
②H-O 键比H-N键(填“强”或“弱”)_____;
①图中b点,v(正)_____v(逆).(填“>”、“=”或“<”)
②图中a点,容器内气体n(N2):n(NH3)=_____。
(4)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是_______________。
(5)电解法能将碱性溶液中的NO2-转化为N2而除去,其电极反应式是_______________。
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:
(1)NO的危害在于 。
a.破坏臭氧层 b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合 d.当它转化为N2后使空气中O2含量降低
(2)NH3与氧气反应可生成NO,化学方程式为 ;若参加反应的NH3为6 mol,则反应中转移了__________mol电子。
(3)一定条件下NO可转化为N2O和另一种红棕色气体,化学方程式为 。
(4)将0.05molNO和0.03molO2气体混合再以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质的物质的量浓度为(设溶液体积变化忽视不计) 。
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入2mol∙L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示。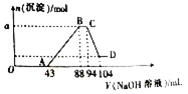
(1)写出OA段反应的离子方程式:____________________________。
(2)B点时溶液中含有溶质的化学式为____________。
(3)a的数值为__________。
(4)原硝酸溶液中HNO3的物质的量为__________mol。
氮元素在自然界中存在多种价态,结合题干回答下列问题:
23.氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。
24.氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)。
a.NH3比PH3稳定性强
b.氮气与氢气能直接化合,磷与氢气很难直接化合
c.硝酸显强氧化性,磷酸不显强氧化性
d.氮气常温是气体,磷单质是固体
25.已知,氯胺NH2Cl熔点-66℃,NH4Cl熔点340℃,氯胺的电子式为 ,从物质结构的角度解释两者熔点相差较大的原因 。
26.NH2Cl比HClO稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,NH2Cl发生水解的化学方程式为 。
27.工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH在10.7左右时,反应过程中生成AlO2-、氮气和氨气,若氮气和氨气的体积比为4:1,则还原剂和氧化剂的物质的量之比为 ,若氮气和氨气的体积比为1:1,则除去0.1mol NO3-,消耗铝______g。
(共16分)
(1)在标准状况下,由CO2和SO2组成的混合气体8.96L,质量是23.6g。此混合物中CO2和SO2的物质的量比是 ① ,SO2的体积分数是 ② , S和O的原子个数比是 ③ 。
(2)现有200 ml Fe2(SO4)3的溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是 ④ 。
(3)在反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,得电子的物质是 ⑤ ,参加反应HNO3的和被还原的HNO3分子个数比为 ⑥ ,当生成的NO在标准状况下的体积为11.2L时,该反应转移的电子的物质的量为 ⑦ mol。