下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
⑴下列叙述中正确的是(填序号) 。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越大。
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。
C.硝酸的浓度越大,还原产物中N元素低化合价产物越多。
D.当硝酸密度大于1.3 g·cm-3时,还原产物主要为NO、NO2
⑵ 当硝酸溶液的密度为1.36 g·cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号) 。
A.2Fe + 10HNO3 ="=" 2Fe(NO3)3 + NO↑+3NO2↑+5H2O
B.4Fe + 18HNO3 ="=" 4Fe(NO3)3 + 3NO↑+3NO2↑+9H2O
C.3Fe + 12HNO3 ="=" 2Fe(NO3)3 + Fe(NO3)2 + 2NO↑+2NO2↑+3H2O
⑶ 密度为1.26 g·cm-3,质量分数为50.0 %的硝酸,其物质的量浓度是 mol·L-1。
⑷ 限用下列仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(不考虑N2O4)。设计一个合理而简单的实验方案(仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略)。
第1步:反应并收集生成的气体:
①实验中气体发生装置应选择 (填装置序号),理由是 。
②装置的连接顺序是(填各装置接口的序号):[ ]→[ ] [ ]→[8] [9]→[ ]。
③检查装置气密性后,开始反应。待E中充满红棕色气体,停止实验。
第2步:验证E中有NO。
④ 取下试管E,倒立在F中,轻轻摇动试管。
确认生成的气体中有NO的现象是 。
某同学取一定量的Al、Fe混合物,与2.0L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐。在反应后的溶液中,逐滴加入4mol·L-1的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示。分析图像回答问题:
(1)DE段发生反应的离子方程式为:_____________________________________ 。
(2)请写出任意一个Al、Fe与极稀HNO3反应的化学方程式:_______________ 。
(3)B点对应的沉淀的物质的量为_______mol,C点对应的氢氧化钠溶液的体积为______mL。
(4)原硝酸溶液的物质的量浓度为_______mol/L。
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
某化学兴趣小组模拟该处理过程的实验装置如 下:
下:
①假如需要检验装置A中产生的气体,请写出一种常用方法 。
②装置C的作用是 。
③写出装置F中发生反应的离子方程式 。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应,
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 (II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 (填字母)。
A.1.9 B.1.3 C.1.2 D 1.6
②将1mol NOx 通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如图所示:
图中线段b表示 离子随x值变化的关系;若用溶质质量分数为20.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少 g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加40g,则NOx中的x值为 。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是 。
(14分)近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
①在图示的转化中,被还原的元素是 ,X的化学式为 。
②SCR技术可使NOx与NH3的直接反应,实现无害转化。当NO与NO2的物质的量之比为4:1时,写出发生反应的化学方程式: 。
(2)加入过量次氯酸钠可使废水中NH4+完全转化为N2,而本身被还原为NaCl。
①写出上述反应的离子方程式: 。
②若处理废水产生了0.448 L N2(标准状况),则需消耗浓度为0.5 mol·L—1的次氯酸钠的体积为 mL。
(3)某工业废水中含有毒性较大的CN—,可用电解法将其转变为N2,装置如图所示。气体甲是 (写化学式),电解池中生成N2的电极反应式为 。
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子(指H+)形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴、写出N2H62+在足量碱性溶液中反应的离子方程式
。
⑵、NH2-的电子式为 。
⑶、N3-有 个电子。
⑷、写出二种由多个原子组成的含有与N3-电子数相同的物 质的化学式 。
质的化学式 。
⑸、等电子数的微粒往往具有相似的结构,试预测N3—的构型 。
⑹、据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为__________(填化学式)。
(2)要得到稳定的HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是_________(填序号)。
| A.稀硫酸 | B.二氧化碳 | C.二氧化硫 | D.磷酸 |
(3)工业废水中的NO2-可用铝粉除去.已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质.将氧化剂和还原剂的化学式及其配平后的系数填入下列横线上:_________________________ + _________________________
上述反应后废水的pH值将________(填“增大”、“减小”或“不变”)。
(4)向20mL 0.01mol·L-1的NaNO2溶液中加入10mL 0.01 mol·L-1的AgNO3溶液,一段时间后,溶液中的c(Ag+)=________________________________。(已知:KSP(AgNO2)=2×10-8 mol2·L-2)
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
水是生命之源,也是化学反应中的主角。试回答下列问题:
(1)写出水分子的结构式 。
(2)全部由短周期元素组成的A、B、C三种物质,是中学化学常见的有色物质,它们均能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂。请写出A、B、C与水反应的化学方程式:
①A+H2O ;
②B+H2O ;
③C+H2O 。
NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:
(1)NO的危害在于 。
a.破坏臭氧层 b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合 d.当它转化为N2后使空气中O2含量降低
(2)NH3与氧气反应可生成NO,化学方程式为 ;若参加反应的NH3为6 mol,则反应中转移了__________mol电子。
(3)一定条件下NO可转化为N2O和另一种红棕色气体,化学方程式为 。
(4)将0.05molNO和0.03molO2气体混合再以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质的物质的量浓度为(设溶液体积变化忽视不计) 。
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入2mol∙L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示。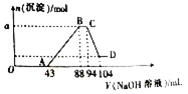
(1)写出OA段反应的离子方程式:____________________________。
(2)B点时溶液中含有溶质的化学式为____________。
(3)a的数值为__________。
(4)原硝酸溶液中HNO3的物质的量为__________mol。
氮元素在自然界中存在多种价态,结合题干回答下列问题:
23.氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。
24.氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)。
a.NH3比PH3稳定性强
b.氮气与氢气能直接化合,磷与氢气很难直接化合
c.硝酸显强氧化性,磷酸不显强氧化性
d.氮气常温是气体,磷单质是固体
25.已知,氯胺NH2Cl熔点-66℃,NH4Cl熔点340℃,氯胺的电子式为 ,从物质结构的角度解释两者熔点相差较大的原因 。
26.NH2Cl比HClO稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,NH2Cl发生水解的化学方程式为 。
27.工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH在10.7左右时,反应过程中生成AlO2-、氮气和氨气,若氮气和氨气的体积比为4:1,则还原剂和氧化剂的物质的量之比为 ,若氮气和氨气的体积比为1:1,则除去0.1mol NO3-,消耗铝______g。
(共16分)
(1)在标准状况下,由CO2和SO2组成的混合气体8.96L,质量是23.6g。此混合物中CO2和SO2的物质的量比是 ① ,SO2的体积分数是 ② , S和O的原子个数比是 ③ 。
(2)现有200 ml Fe2(SO4)3的溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是 ④ 。
(3)在反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,得电子的物质是 ⑤ ,参加反应HNO3的和被还原的HNO3分子个数比为 ⑥ ,当生成的NO在标准状况下的体积为11.2L时,该反应转移的电子的物质的量为 ⑦ mol。
(原创) (14分)通过对模型、图形、图表的观察,获取有关信息是化学学习的一种重要能力。请按要求回答下列问题:
(1)图1是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
①Y元素在元素周期表中的位置为 。
②气态氢化物的稳定性:X_____(填“>”“<”)Y。
③这五种元素形成的简单离子中,离子半径最大的是_______(填离子符号)。
④Z的氢化物ZH可以和水发生氧化还原反应,其反应方程式为 。
(2)图2是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是__________
| |
甲 |
乙 |
丙 |
丁 |
| A |
FeCl3 |
FeCl2 |
Fe2O3 |
Fe(OH)3 |
| B |
Cu |
CuO |
CuSO4 |
CuCl2 |
| C |
NO |
HNO3 |
NO2 |
NH3 |
| D |
Si |
Na2SiO3 |
SiO2 |
SiF4 |
(3)图3表示将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系,则ab段发生反应的离子方程式为_______________________________
某同学取一定量的Al、Fe混合物,与2.0L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐。在反应后的溶液中,逐滴加入4mol·L-1的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示。分析图像回答问题:
(1)DE段发生反应的离子方程式为:_____________________________________ 。
(2)请写出任意一个Al、Fe与极稀HNO3反应的化学方程式:_______________ 。
(3)B点对应的沉淀的物质的量为_______mol,C点对应的氢氧化钠溶液的体积为______mL。
(4)原硝酸溶液的物质的量浓度为_______mol/L。
(1)大气中SO2含量过高会导致雨水中含有 (填化学式)而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为 。
(2)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01mol I2,参加反应的SO2为 mol。
 (3)合成氨的反应N2(g)+3H2(g)
(3)合成氨的反应N2(g)+3H2(g)  2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a.升高温度 b.加入催化剂 c.增加H2的浓度
d.增加N2的浓度 e.分离出NH3  (4)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。