(9分)将一支盛有a mL NO和b mL NO2气体的试管倒立于水槽中,然后通入a mL O2,问:
(1)若a=b,则充分反应后试管内气体体积为__________mL。
(2)若a<b,则充分反应后试管内气体体积为__________mL。
(3)若a>b,则充分反应后试管内气体体积为__________mL。
(每空3分,共18分)制取氨气并完成喷泉实验(图中夹持装置均以略去)
(1)写出氨气催化氧化的化学方程式: 。
(2)收集氨气使用 方法,要得到干燥的氨气可选用 做干燥剂。
(3)用甲装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。
该实验的原理是 。
(4)如果只提供乙图装置,请设计引发喷泉的方法: 。
将 3a L NO2 气体依次通过盛有下列物质的容器:饱和NaHCO3 溶液、浓硫酸、固体Na2 O2 ,发生反应的化学方程式是(1)________,(2)________,(3)________。最后用排水法收集残余气体,收集到的气体是________,体积是________L。
常温下A和B两种气体组成的混合气体(A的相对分子质量大于B的相对分子质量),经分析混合气体中只含有氮和氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于14/3。由此可确定A为________,B为________,其理由是______________________________________。
若上述混合气体的氮和氢的质量比为7∶1,则在混合气体中A和B的物质的量之比为________,A在混合气体中的体积分数为________。
(1)在硝酸生产过程中所排放出来的废气中含有NO和NO2 ,它们污染环境,现用氨催化还原法将它们转化为无毒气体________(填化学式)直接排入空气中,写出有关反应方程式:________、________。
(2)假设NO和NO2 物质的量之比恰好为1∶1,则两者的混合物相当于一种酸酐,写出由烧碱溶液吸收这种酸酐的化学方程式________________________。
将还原性铁粉分别放入冷的浓H2SO4 、浓HNO3 中,开始都有大量气泡生成,后来反应不再发生。已知生成的气体有刺激性气味,H2SO4 中生成的气体呈无色,HNO 3 中生成的气体呈红棕色;剩余的固体经检验有磁性。试回答:
(1)Fe的氧化产物是________。(写化学式,下同)
(2)浓H2 SO4 的还原产物是________,浓HNO3 的还原产物是________。
某学生课外活动小组利用下图所示装置分别做如下实验: 
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________。
(7分)现有部分元素的原子结构特点如下表:
| X |
L层电子数是K层电子数的3倍 |
| Y |
核外电子层数等于原子序数 |
| Z |
L层电子数是K层和M层电子数之和 |
| W |
最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图:____________。
(2)元素X与元素Z相比,非金属性较强的是______(填元素符号),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:____________________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为________。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:_______________。
氮及其化合物与人类各方面有着密切的联系。
Ⅰ.将一支充满标准状况下的NO2的试管倒置于水槽中,则试管中溶液的物质的量浓度为 (假设试管中的溶液不扩散);若试管中混有N2O4气体,则试管中溶液的物质的量浓度将 。(填偏大、偏小或不变)
Ⅱ.目前,消除氮氧化物污染有多种方法。
(1)用NH3转化法,在催化剂条件下可将NO、NO2转化成无毒的气体。写出NH3 与NO2反应的化学方程式并标出电子转移方向和数目 。
(2)用VLNaOH溶液完全可以吸收含aL NO、bL NO2、cL N2O4的混合气体(标准状况下),则NaOH溶液的物质的量浓度至少为 。
已知:2NO2+2NaOH=NaNO2+ NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O
某反应体系中的物质有:NF3、HF、NO、HNO3、H2O。请根据要求回答下列问题:
(1)请将方程式补全,并配平。 NF3+ ="=" HF + + ;
(2)反应过程中,被氧化与被还原的元素的物质的量之比为_______________;
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 ;一旦NF3泄漏,可以用___________(填化学式)溶液喷淋的方法减少污染。
(4)H2O与H2O2都是由氢、氧两种元素形成的化合物。其中H2O2可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2 + H2O ="=" A + NH3↑,试指出生成物A的化学式为__________。
(1)实验室制NH3的反应方程式为_____________________________________
(2)氨的催化氧化是工业制取硝酸的基础,写出化学反应方程式。
(3)硝酸具有强氧化性,它能和许多物质发生反应。写出浓硝酸与非金属单质碳的反应方程式。
(4)写出稀硝酸与金属银在加热条件下的反应方程式 _______________________________________________________
下列框图所示的转化关系中,甲为生活中常见的金属单质,乙、丙、丁为气体单质,D为家庭中常用物质(部分反应物和生成物及溶剂水已略去)。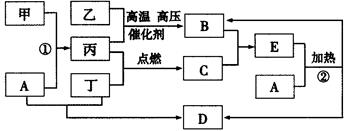
请回答:
(1)E的化学式为____________;甲的原子结构示意图为____________;
(2)反应①的离子方程式为____________________________________;
反应②的化学方程式为____________________________________;
(3)实验室制取并收集B的操作中,用____________法收集B,验证B已收集满的方法是_______________________________________________(限答一种)。
(4)实验室制备丁的方程式为____________________________________,工业上输送丁的管道出现气体泄漏,如何查漏(用方程式表示)______________________。
实验室常用硫酸铝溶液和氨水反应制取氢氧化铝,其离子方程式为 ;
溶液中得到的氢氧化铝是______色______状物质。它是______溶于水的______性化合物,既能与______反应,又能与______反应,其离子方程式分别是 、 。
将64g铜与280mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入VmLamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
化学对人体健康和人类生活有着十分重要的作用。请回答下列问题:
(1)抗胃酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。抗胃酸药物具有抗酸作用的原因是_____________________________________。某品牌抗酸药的主要成分有糖衣、碳酸氢钠、氢氧化铝、淀粉。写出该抗酸药发挥功效时的离子方程式:________________________________、_______________________________。
(2)甲同学患了夜盲症,可能的原因之一是体内缺少维生素 (A、B、C、D,下同);乙同学在刷牙时牙龈经常出血,该同学在平时应多吃富含维生素 食物。
(3)铝的金属活动性比较强,铝在空气中却比较稳定,其原因是
(4)为了改善空气质量,必须控制二氧化硫氮氧化物烟尘等污染物的排放量,对汽车加装尾气催化净化装置,可使其中的NO和CO转化为无毒气体,该反应的化学方程式为 。