向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是( )
| A.Cu与Cu2O 的物质的量之比为2:1 | B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L | D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体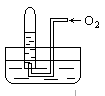
| A.可能是N2与NO2的混和气体 |
| B.只能是NO2一种气体 |
| C.可能是N2与NO的混和气体 |
| D.可能只有NO2气体也可能是O2与NO2的混和气体 |
将充有amLNO和bmLNO2的试管倒立于水槽中,然后再通入amLO2,若a<b,则充分反应后,试管内剩余气体的体积是
A.( |
B. |
C. |
D. |
下列转变过程属于氮的固定的是
| A.氨气和HCl气体混合生成NH4Cl固体 | B.氨的催化氧化 |
| C.工业上用N2和H2 合成氨 | D.NO遇到空气变为红棕色 |
下列关于浓硝酸和浓硫酸的叙述,正确的是
| A.常温下都用铜容器贮存 | B.露置在空气中,容器内酸液的质量都减轻 |
| C.常温下都能与铜较快反应 | D.露置在空气中,容器内酸液的浓度都降低 |
下列说法中正确的是
| A.氮元素是活泼的非金属元素,因此N2的化学性质也很活泼 |
| B.NO2溶于水生成硝酸,因此NO2是硝酸的酸酐 |
| C.雷雨时,可增加土壤中硝酸盐类氮肥的含量,此变化属于氮的固定 |
| D.氮气不能做焊接金属时的保护气 |
下列叙述中,不正确的是
| A.浓硫酸可以作CO2、Cl2气体的干燥剂 |
| B.浓HNO3与金属反应时,HNO3常被还原为NO2 |
| C.实验室中浓硝酸要在棕色试剂瓶中密封保存,并放在阴凉处 |
| D.常温时,可以用铁质容器储存浓盐酸 |
用一充满氨气的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内的氨水的物质的量浓度是(按标准状况下计算)
| A.0.045mol·L-1 | B.1mol·L-1 | C.0.029mol·L-1 | D.不能确定 |
常温常压下,把二氧化碳和一氧化碳的混合气体V mL缓缓通过足量的过氧化钠固体,气体体积缩小到 mL,则二氧化碳和一氧化氮的体积比不可能是
mL,则二氧化碳和一氧化氮的体积比不可能是
| A.2:1 | B.3:2 | C.3:4 | D.5:4 |
室温时,在容积为amL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入bmLO2,则管内液面又继续上升,测得试管内最后剩余气体为cmL,且该气体不能支持燃烧。则a、b、c的关系是 ( )
| A.a=4b+3c | B.a=4b+c | C.a:b=4:1 | D.a:b=4:3 |
在100mL混合溶液中, 和
和 物质的量浓度分别为
物质的量浓度分别为 和
和 ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中 物质的量浓度(
物质的量浓度(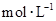 )为
)为
| A.0.15 | B.0.225 | C.0.35 | D.0.45 |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
| A.集气瓶中产生的沉淀是硫酸钡 |
| B.Z导管出来的气体中无二氧化碳 |
| C.集气瓶中产生的沉淀是碳酸钡 |
| D.Z导管口有出现气体无色 |
右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压胶管的胶头,下列与试验事实不相符的是
| A.CO2(NaHCO3溶液) 无色喷泉 |
| B.NH3(H2O含酚酞) 红色喷泉 |
| C.H2S(CuSO4溶液) 黑色喷泉 |
| D.HCl(AgNO3溶液) 白色喷泉 |