某学校化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c、d表示止水夹)。请按要求回答下列问题:
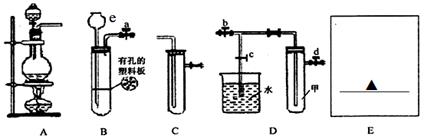
(1)用浓盐酸和MnO2加热反应制取氯气时,需选用上述装置(填字母,除杂和干燥装置略) 和C;还需补充装置E,并在上方方框内画出装置简图,并标注其所盛药品的名称。
(2)用稀盐酸和大理石常温下反应制备CO2时选装置B,B中仪器e的名称为 ,反应的离子方程式为 。
(3) 欲用D装置验证NO2是否能与水(滴有紫色石蕊试液)反应,其操作步骤为:①打开止水夹b、d,关闭止水夹c,并由b处通入一段时间的NO2到甲中充满红棕色气体;②关闭止水夹b、d,同时打开止水夹c,③然后 (写具体操作),观察到的现象有 。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为: .
(2)在一定体积的10mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 .
(3)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体.若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是 .
在某稀溶液中含有0.2molHNO3和xmolH2SO4,向其中加入19.2g铜粉,充分反应后产生的气体在标注状况下的体积为4.48L,则x值至少为
| A.0.6 | B.0.4 | C.0.3 | D.0.2 |
用以下三种途径来制取等质量的硝酸铜:①铜与稀硝酸反应;②铜与浓硝酸反应;③铜先与氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述不正确的是
| A.三种途径所消耗的铜的质量相等 |
| B.所消耗的硝酸的物质的量是①>②>③ |
| C.途径③的制备方法是最符合“绿色化学”理念的 |
| D.途径①中被氧化的铜与被还原的硝酸的物质的量比是3:2 |
某学习小组为研究铜与浓、稀HNO3反应的差异,设计了如图所示的实验装置。

实验步骤如下:
Ⅰ.检查装置的气密性;
Ⅱ.向装置A中通入过量的CO2气体,关闭弹簧夹;
Ⅲ.滴加浓硝酸;
……
(1)步骤Ⅲ中滴加浓硝酸的具体操作是 。
(2)A装置中反应的化学方程式是 。
(3)B中溶液慢慢变成蓝色,能解释此现象的化学方程式是 。
(4)证明B中有NO生成的实验操作是 。
(5)步骤Ⅱ向装置A中通入过量CO2气体的目的是 。
(6)上述实验结束后,观察到A装置中的溶液呈绿色,B装置中的溶液呈蓝色。在分析溶液为绿色的原因时,甲同学用加水稀释的方法,乙同学认为不合理,因在稀释时,也会引起Cu2+浓度变化。请设计实验证明绿色是由溶有NO2引起的 。
氮氧化物进入大气后,可能会形成硝酸型酸雨,因此必须对含有氮氧化物的废气进行处理。
(1)用NaOH可以吸收废气中的氮氧化物,反应的化学方程式如下:2NO2 + 2NaOH  NaNO2 + NaNO3 + H2O 反应中,还原剂是 ,NO2 + NO + 2NaOH
NaNO2 + NaNO3 + H2O 反应中,还原剂是 ,NO2 + NO + 2NaOH  2NaNO2 + H2O 反应中,氧化产物和还原产物之比为 。
2NaNO2 + H2O 反应中,氧化产物和还原产物之比为 。
(2)NO2和Br2蒸汽都是红棕色气体,下列可以用来鉴别这两种气体的试剂是 。
| A.用氢氧化钠溶液 | B.淀粉碘化钾溶液 | C.用硝酸银溶液 | D.用蒸馏水 |
(3)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成两种对大气无污染的气体,该反应的化学方程式为 。
(4)氨气也可用来处理氮氧化物,例如:氨气与二氧化氮反应生成氮气和水,写出该反应的化学方程式: ,若某工厂排出的废气中二氧化氮含量为0.5%(体积分数),处理1000m3(标准状况)这种废气,需要 千克氨气。(结果保留两位小数)
某些化学反应可表示为: A + B → C + D+H2O(未注明反应条件)请回答下列问题:
(1)若A、C、D均含氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:
。
(2)若A为紫红色金属,D为红棕色气体,请写出该反应的化学方程式:
。
(3)若A为不含金属元素的盐,B为碱,则检验气体C的方法是: 。
(4)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
1.92 g Cu投入到一定量的浓硝酸中,铜完全溶解,生成的气体的颜色越来越浅,共收集到 672 mL 的气体(标准状况下).将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )
| A.0.336L | B.0.224L | C.0.168L | D.0.504L |
硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O ①
4NO+6H2O ①
4NO+3O2+2H2O→4HNO3 ②
完成下列计算:
(1)如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是 (保留至1%)。
(2)某化肥厂以氨为原料通过题干中反应先产生硝酸,再利用氨气和硝酸反应制NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为 m3(保留整数部分)。
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
| |
现象 |
解释 |
| A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
| B |
SO2能使酸性高锰酸钾溶液褪色 |
SO2具有还原性 |
| C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| D |
铁与稀硝酸反应有气泡产生 |
铁与稀硝酸发生了置换反应 |
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
铜镁合金9.2g完全溶于浓硝酸中,反应中硝酸钡还原只产生10304mL(标准状况下)NO2气体。向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A.16.51g | B.23.82g | C.24.84g | D.17.02g |
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在以下转化关系:
试回答下列问题:
(1)甲是_________,B是________。(填化学式)
(2)乙的溶液通常呈黄色,写出消除黄色且不降低乙溶液的浓度的方法:________________。
(3)写出生成混合气体A的化学方程式____________________________________。
(4)写出乙的稀溶液与单质丙反应的离子方程式:_______________________________________。