1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是
| A.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.该合金中铜与镁的物质的量之比是2:1 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
氯碱工业生产中用氨气检查氯气管道是否泄漏,氨气遇到氯气会产生白烟,
(1)反应还生成了一种无毒的气态单质,写出反应的化学方程式 ________________________。
(2)在该反应中,氧化剂是____________,还原产物是____________,当有1.7g的氨气参与反应时,转移的电子数目为____________。
(3)列式计算当有112 mL的氯气(已折算到标准状况)参加反应时生成白烟的质量为________ g。
将一定质量的铜溶于50mL11mol/L的浓硝酸中,待铜完全溶解后,生成0.2molNO2和NO的混合气体,并测得溶液中H+的浓度为1mol/L.假设反应后溶液的体积仍为50mL,则金属铜的质量为( )
| A.6.4g | B.9.6g | C.11.2g | D.12.8g |
向一定量的Fe,FeO,Fe2O3,Fe3O4的混合溶液中,加入150mL 4mol/L的稀硝酸,恰好使混合物完全溶解,并放出标准状况下NO气体2.24L,往所得溶液中加KSCN溶液,无红色出现。若用足量的氢气在加热条件下还原相同质量的该混合物,所得铁的物质的量可能为
| A.无法计算确定 | B.0.50mol | C.0.25mol | D.0.60mol |
某学校化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c、d表示止水夹)。请按要求回答下列问题:
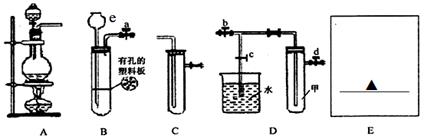
(1)用浓盐酸和MnO2加热反应制取氯气时,需选用上述装置(填字母,除杂和干燥装置略) 和C;还需补充装置E,并在上方方框内画出装置简图,并标注其所盛药品的名称。
(2)用稀盐酸和大理石常温下反应制备CO2时选装置B,B中仪器e的名称为 ,反应的离子方程式为 。
(3) 欲用D装置验证NO2是否能与水(滴有紫色石蕊试液)反应,其操作步骤为:①打开止水夹b、d,关闭止水夹c,并由b处通入一段时间的NO2到甲中充满红棕色气体;②关闭止水夹b、d,同时打开止水夹c,③然后 (写具体操作),观察到的现象有 。
有6mL NO和18mLNO2组成的混合气体的容器,倒置在盛有水的水槽中(保持温度、压强不变),当缓慢充入同温同压下的氧气x mL并摇动容器,容器内气体体积为0(即水全部充入容器内),则x的值为( )
| A.9 | B.12 | C.18 | D.24 |
在某稀溶液中含有0.2molHNO3和xmolH2SO4,向其中加入19.2g铜粉,充分反应后产生的气体在标注状况下的体积为4.48L,则x值至少为
| A.0.6 | B.0.4 | C.0.3 | D.0.2 |
下列两种物质发生反应
①Na和O2 ②AlCl3与氨水 ③水玻璃与CO2 ④Fe与Cl2 ⑤Fe和稀HNO3,因反应物用量或反应条件的不同而生成不同产物的是()
| A.①②③④⑤ | B.①②③⑤ | C.①②⑤ | D.①③⑤ |
某学习小组为研究铜与浓、稀HNO3反应的差异,设计了如图所示的实验装置。

实验步骤如下:
Ⅰ.检查装置的气密性;
Ⅱ.向装置A中通入过量的CO2气体,关闭弹簧夹;
Ⅲ.滴加浓硝酸;
……
(1)步骤Ⅲ中滴加浓硝酸的具体操作是 。
(2)A装置中反应的化学方程式是 。
(3)B中溶液慢慢变成蓝色,能解释此现象的化学方程式是 。
(4)证明B中有NO生成的实验操作是 。
(5)步骤Ⅱ向装置A中通入过量CO2气体的目的是 。
(6)上述实验结束后,观察到A装置中的溶液呈绿色,B装置中的溶液呈蓝色。在分析溶液为绿色的原因时,甲同学用加水稀释的方法,乙同学认为不合理,因在稀释时,也会引起Cu2+浓度变化。请设计实验证明绿色是由溶有NO2引起的 。
某厂每天产生800m3含氮的废水(NH3的含量为168mg∙L-1)。该厂处理废水的方法是:将废水加热得到NH3,使废水中NH3的含量降为15mg∙L-1(假设废水处理前后体积不变)。再对加热蒸发得到的NH3进一步处理制取硝酸。
(1)制取硝酸过程中主要发生反应如下:①_________________,②4NO+3O2+2H2O=4HNO3。反应①是氨气在一定条件下被氧气氧化,请在横线上写出该反应的化学方程式。
(2)该厂每天通过加热蒸发可得到NH3的物质的量是__________________。
(3)若在反应①中N元素损失10%,则该厂每天可生产硝酸多少吨?(写出计算过程,结果保留2位小数)
某些化学反应可表示为: A + B → C + D+H2O(未注明反应条件)请回答下列问题:
(1)若A、C、D均含氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:
。
(2)若A为紫红色金属,D为红棕色气体,请写出该反应的化学方程式:
。
(3)若A为不含金属元素的盐,B为碱,则检验气体C的方法是: 。
(4)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
在浓硝酸中放入铜片发生反应:
(1)待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是 (用离子方程式表示)
(2)若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6L(标况)。则所消耗硝酸的物质的量是 mol
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是 mol
硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O ①
4NO+6H2O ①
4NO+3O2+2H2O→4HNO3 ②
完成下列计算:
(1)如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是 (保留至1%)。
(2)某化肥厂以氨为原料通过题干中反应先产生硝酸,再利用氨气和硝酸反应制NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为 m3(保留整数部分)。