氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
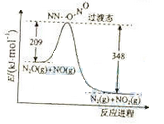
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H= kJ·mol-1。
(1)①比较0.1mol/L的下列各种溶液的pH大小:CH3COONa_______NaClO;(填“>”、“<”或“=”)
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系______________。
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。混合溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式________________
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K= 。
②该反应为 反应(选填吸热、放热)。
③能判断该反应是否达到化学平衡状态的依据是 。
(A)容器中压强不变 (B)混合气体中 [CO]不变
(C)v正(H2)=v逆(H2O) (D)C(CO2)=C(CO)
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,

则上述CO2转化为甲醇的反应的△H3__________0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。试回答:0~10 min内,氢气的平均反应速率为 mol/(L·min);该温度下,反应的平衡常数的值为 ;第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数 (填变大、减少、不变)。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其原因用离子方程式表示为 ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+) + c(H+)__________c(NO3-) + c(OH-)(填写 “>”“=”或“<”)
(1)将 (某一元酸)溶液与
(某一元酸)溶液与 溶液等体积混合,测得混合溶液中
溶液等体积混合,测得混合溶液中 ,则此溶液中
,则此溶液中 ;
; 此溶液中由水电离出的
此溶液中由水电离出的
 溶液中由水电离出的
溶液中由水电离出的 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)将等体积 的盐酸和醋酸,加入适量水,
的盐酸和醋酸,加入适量水, 都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
(3)常温下,某酸 (A为酸根)与某碱
(A为酸根)与某碱 溶液恰好完全反应生成正盐,该溶液
溶液恰好完全反应生成正盐,该溶液 。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用,但硫的氧化物直接排放到大气中会造成污染。
(1)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4

从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用右图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
(2) 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。

①写出图中由2到3段的反应离子方程式 。
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 (用离子方程式表示)。
查文献知,CH3COOH、H3PO3、H3PO4三种酸所有的逐级电离常数如下:
| 酸 |
电离常数(Ka) |
酸 |
电离常数(Ka) |
| CH3COOH |
1.8×10-5 |
H3PO4 |
K1=7.11×10-3 |
| H3PO3 |
K1=3.7×10-2 |
K2=6.23×10-8 |
|
| K2=2.9×10-7 |
K3=4.5×10-13 |
用化学用语回答下列问题:
(1)上述三种酸中,酸性最强的是__________ ;
(2)常温下,在NaH2PO3稀溶液中:c(H3PO3) < c(HPO32—),则该溶液pH_______7;(填“>”“<”或“=”)
(3)等温度、等浓度的NaH2PO4溶液与Na2HPO4溶液比较,c(H3PO4)较大的是:_____;
(4)25℃时,浓度均为0.01 mol/L 的CH3COONa、Na2HPO3、Na3PO4溶液,pH最大的是:_________________;
(5)写出少量H3PO4溶液与CH3COONa溶液混合后,反应的离子方程式:_________
________________________________;
等温度、等浓度的NaH2PO3溶液与NaH2PO4溶液中,粒子间存在等量关系:c(H3PO3)+________ _____= 3c(PO43—) +_____________________—c(H+)。(用对应溶液中其它粒子浓度补充完整)
直接排放含的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的
,
(1)用化学方程式表示形成硫酸型酸雨的反应:。
(2)在钠碱循环法中,溶液作为吸收液,可由
溶液吸收
制得,该反应的离子方程式是
(3)吸收液吸收的过程中,
随
变化关系如下表:
| 91:9 |
1:1 |
1:91 |
|
| 8.2 |
7.2 |
6.2 |
①上表判断溶液显性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.,
b.
c.
(4)当吸收液的降至约为6时,需送至电解槽再生。再生示意图如下:

①在阳极放电的电极反应式是。
②当阴极室中溶液升至8以上时,吸收液再生并循环利用。简述再生原理:
(10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;
(2)氯化铝水溶液呈 性,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表
示): ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用: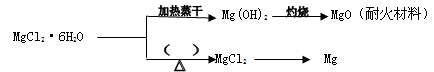
请回答下列问题:
①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)  Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,在室温时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵晶体:

ⅰ.酸性条件下,铈在水溶液中有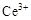 、
、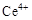 两种主要存在形式,
两种主要存在形式,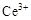 易水解,
易水解,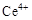 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵晶体广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂C的是 。
| A.NaClO | B.H2O2 | C.KMnO4 | D.浓硫酸 |
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(3)反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号);反应①的离子方程式为 。
(4)用滴定法测定制得的Ce(OH)4产品纯度:

滴定时所用定量仪器的最小刻度为 ;所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
(共14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组分析,HA是 酸(填强或弱)。所得混合溶液由水电离出c(OH-) = mol·L-1。
(2)②组表明,c 0.2(选填“>、=或 <”)。
该混合液中离子浓度c(A-)与c(Na+)的大小关系是 。(选填“>、=或 <”)
(3)从③组分析,说明此时HA电离程度 NaA水解程度(选填“>、=或 <”)。
该混合溶液中各离子浓度由大到小的顺序是 。
(4)由上述所涉及的溶质组成以下四组等体积溶液:
甲:0.1mol/LNaA; 乙:0.1mol/LNaA和0.1mol/LHA;
丙:0.1mol/LHA; 丁:0.1mol/LNaA和0.1mol/LNaOH;
则A-离子浓度由大到小的顺序为 > > > 。(填写序号)
无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为 ;
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
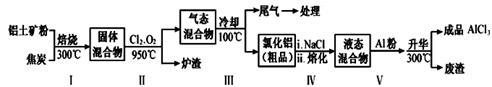
已知:
| 物质 |
SiCl4 |
AlCl3 |
FeCl3 |
FeCl2 |
| 沸点/℃ |
57.6 |
180(升华) |
300(升华) |
1023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是 (只要求写出一种);
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是 ;
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1="+1344.1kJ" ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2="+1169.2kJ" ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 ;
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为 ;
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 。
(1)Na2CO3溶液显_______________性,用离子方程式表示其原因为_________________。
(2)常温下,pH=11的NaHCO3溶液中,水电离出来的c(OH-)=_______________mol/L,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_________mol/L。
(3)已知纯水中存在如下平衡:H2O H++OH-。现欲使平衡逆向移动,且所得溶液显酸性,可选择的方法是__________(填字母序号)。
H++OH-。现欲使平衡逆向移动,且所得溶液显酸性,可选择的方法是__________(填字母序号)。
| A.向水中加入NaHCO3固体 | B.向水中加入NaHSO4固体 |
| C.加热至100℃ | D.向水中加入(NH4)2SO4固体 |
(4)若将等pH、等体积的NaOH溶液和NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m_______n(填“<”“>”或“=”)。
(5)等物质的量浓度的下列溶液:①NaCl; ②NaOH; ③CH3COOH; ④HCl; ⑤CH3COONa ;⑥NaHCO3;⑦Ba(OH)2;⑧Na2CO3,pH由大到小的顺序为_________(填序号)。
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)  TaI4(g)+S2(g) ΔH>0 (Ⅰ)
TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2的晶体,则温度T1______T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为______________,滴定反应的离子方程式为___________________。
(4)25 ℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=________,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=________,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Na+、Al3+、Ba2+、NH4+ |
| 阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是______________,上述四种离子浓度的大小顺序为(填序号)________________。
(2)若四种离子的关系符合③,则溶质为________________;若四种离子的关系符合④,则溶质为__________________。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是(填图象符号)________。

若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”)。