室温下取0.2 mol·L-1HA溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)①混合溶液中水电离出的c(OH-) 0.1mol·L-1NaOH溶液中水电离出的c(OH-);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+) -c(A-)= mol·L-1
c(OH-)-c(HA) = mol·L-1
(2)室温下如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH>7,则说明HA的电离程度 NaA的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为 。
化学反应原理是中学化学学习的重要内容。请回答下列问题:
(1)下列判断正确的是______________。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH2
则ΔH1﹤ΔH2
②H2(g)+ O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
则ΔH1﹤ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1﹤Q2
④CaCO3(s)===CaO(s)+CO2(g)ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s)ΔH2
则ΔH1﹤ΔH2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)
设计的原电池如图所示。

请回答下列问题:
①铜电极发生的电极反应为_____________________。
②溶液中Cu2+向________极移动。
(3)在一恒温、恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。

回答下列问题:
①Y的化学式是 。
②反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率,v(H2)= mol·L-1·min-1。
③能证明该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积分数保持不变 |
| B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) |
| D.混合气体的平均相对分子质量不变 |
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(4)室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如下图所示。下列有关溶液中离子、分子浓度大小关系的描述中正确的是____________。
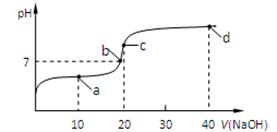
①.a点时:c(CH3COOH) >c(CH3COO-) > c(Na+) > c(H+) >c(OH-)
②.b点时:c(Na+)=c(CH3COO-) >c(H+) =c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)> c(CH3COO-) > c(OH-) >c(H+)
常温下,如果取0.1mol·L-1HCl溶液与0.1mol·L-1MOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=5,请回答下列问题:
(1)混合后溶液的pH=5的原因(用离子方程式表示):
(2)混合溶液中由水电离出的H+浓度是0.1mol·L-1HCl溶液中由水电离出的H+浓度的 倍。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Cl-)-c(M+)= mol·L-1,c(H+)-c(MOH)= mol·L-1。
(4)已知CH3COOM溶液为中性,HF常温下电离常数为6.8×10-4,CH3COOH电离常为1.7×10-5。
则MF溶液的pH 7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
| A.MHCO3 | B.CH3COOM | C.MClO | D.MCl |
按pH由小到大的顺序排列: (填序号)。
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。
已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式:
。
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H= kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为___________________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=_____________________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” ,下同)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-).
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验 编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,用a来说明HA是强酸还是弱酸,若a 7,则HA是强酸;若a 7,则HA是弱酸(填<、>、=)。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 (选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3)丙组实验结果分析,HA是 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
(7分)按要求回答下列问题:
(1)向CH3COOH水溶液中加入水,平衡CH3COOH  H++CH3COO—将向 (填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比 (填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比 (填“增大”、“减小”或“不变”)。
H++CH3COO—将向 (填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比 (填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比 (填“增大”、“减小”或“不变”)。
(2)K通常表示化学平衡常数,对于反应Cl2+ H2O H++Clˉ+HClO其化学平衡常数K的表达式为: 。
H++Clˉ+HClO其化学平衡常数K的表达式为: 。
(3)下列说法中正确的是 。
| A.pH=1和pH=2的盐酸,c(H+)之比为1︰2 |
| B.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系不可能为c(Cl-) > c(H+) > c(NH4+)>c(OH一) |
| C.0.1 mol·L-1的NaHCO3溶液中: c(Na+)>c(HCO3-) >c(CO32-) >c (H2CO3) |
| D.升高温度,弱电解质的电离常数一定增大 |
E.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示。II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b
(1)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数K=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度= 。(计算结果保留小数点后一位)
[B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数K=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度= 。(计算结果保留小数点后一位)
(2)常温下,0.1 mol·L-1的氯化铵溶液pH=5.1.若常温下氨水的电离常数Kb=10-X,则x= 。
(1)将0.2mol/LHA(某一元酸)溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则此溶液中c(OH-)_______ c(H+), c(A-)_______c(HA);c(HA)+ c(A-)______0.1mol/L ;此溶液中由水电离出的c(OH-)______0.2mol/LHA溶液中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)将等体积pH=1的盐酸和醋酸,加入适量水,pH都升高了1,则加水后溶液体积V(醋酸)____V(盐酸)(填“>”、“<”或“=”)。
(3)常温下,某酸 (A为酸根)与某碱
(A为酸根)与某碱 溶液恰好完全反应生成正盐,该溶液
溶液恰好完全反应生成正盐,该溶液 。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
。写出该正盐的化学式____,该盐中____离子一定能水解,其水解离子方程式为_______。
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
(1)由实验①写出HA的电离方程式是 。
(2)以下各空均选填“>、<、=”。
实验②反应后的溶液中:c(A-)+c(HA) 0.1mol·L-1
室温下,将pH=3的HA溶液稀释到原体积的10倍后,溶液的pH 4
室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则a b
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0. 1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;溶液中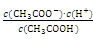 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为___________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气________。
| A.盐酸多 | B.H2A多 | C.一样多 | D.无法确定 |
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_____________________。
下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择,并填空
A. M>N B. M<N C. M=N D. 无法比较
(1)相同温度下,1L 1 mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5 mol/L NH4Cl溶液中NH4+的个数: ;
(2)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
(3)室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,原酸溶液和原碱溶液的物质的量浓度: ;
(4)用惰性电极分别电解NaCl溶液和CuSO4溶液,一段时间后,则两个电解池中前者阴极附近溶液的PH与后者阳极附近溶液的PH大小关系是: ;
(5)同条件下,一堆钢管单独露天堆放,另一堆钢管与铜管露天堆放在一起,则两堆钢管腐蚀的速率: ;
(6)PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是: 。
(1) 一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中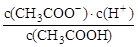 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。
①如果溶液pH=7,此时V的取值__ ___20.00(填“>”、“<”或“=”),而溶液中 c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= _________mol·L-1。
(3)常温下,向20 ml 0.1mol·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:
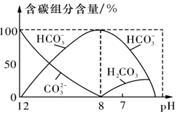
①若将Na2CO3和NaHCO3混合物配成溶液,
则此溶液的pH的取值范围是 ;
②为测定Na2CO3和NaHCO3混合物中的质量分 数,下列方案可行的是 。
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
(9分)现有A、B、C、D、E、F六种无色溶液,它们可能是:CH3COONa溶液、NH4Cl溶液、NaOH溶液、CH3COOH溶液、氨水、NaCl溶液中的某一种。已知B、D两溶液呈酸性,但B溶液中水的电离程度大于D溶液中水的电离程度;A、C、F焰色反应均为黄色,F溶液呈中性,A、C溶液呈碱性,但物质的量浓度相同时,C溶液的pH值大于A溶液的pH值。试回答下列问题:
(1)在A、C、F三种溶液中,水的电离程度由大到小的顺序为 (填序号)。
(2)常温下,将等物质的量浓度,等体积的B、E两溶液相混合,所得混合溶液的pH 7(填“大于”或“等于”或“小于”),溶液中各离子浓度大小关系为 。
(3)常温下,若C溶液中c(OH-)与D溶液中c(H+)相等,将二者等体积混合,所得混合溶液的pH 7(填“大于”或“等于”或“小于”);如果将等物质的量浓度的C、D按a:b的体积比混合,混合溶液的pH恰好等于7(体积变化忽略不计),则D的电离平衡常数为 (用含a、b的表达式表示)。
(4)常温下,若B溶液中c(H+)与C溶液中的c(OH-)相等,现将B、C溶液都稀释10倍,稀释后B溶液的pH值用pHB表示,C溶液的pH值用pHC表示,则pHB+pHC 14(填“等于”、“大于”或“小于”)。
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是
(2)工业上合成氨气的反应为:N2(g) + 3H2(g)  2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率( )与体系总压强(P)、温度(T)的关系如图所示。
)与体系总压强(P)、温度(T)的关系如图所示。
回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= 。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
③平衡状态由A变到B时,对应的平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO |
HSCN |
H2CO3 |
| K=3.2×10-8 |
K=0.13 |
Kl=4.2×10-7 K2=5.6×10-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为
③同浓度的A.NaClO B. Na2CO3 C. NaSCN 比较各溶液pH由大到小的是 (用A.B.C回答)
(1)一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸,用字母填写下列空格:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________________。
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是_________________________。
(2)常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为________mol·L-1。
(3)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)和c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为__________同学的说法正确,理由是____________________________。
(4)明矾[KAl(SO4)2·12H2O]常用作净水剂,其原理是_______________(用离子方程式表示)。
(5)将FeCl3溶液蒸干并灼烧,最终得到的固体物质是______________________(填写化学式)。