草酸(H2C2O4)是二元中强酸,酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。
Ⅰ、某探究小组利用该反应,用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的离子方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。
(3)本滴定达到终点的标志是: ;
(4)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度 ,(填“偏高”、“偏低”、或“不变”)。
Ⅱ、草酸氢钠溶液显酸性,常温下,向10 mL 0.01mol/LNaHC2O4溶液中滴加0.01mol/LNaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是: 。
| A.V(NaOH)=0时,c(H+)= 1×10-2 mol/L |
| B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)= 1×10-7 mol/L |
| D.V(NaOH)>10mL时, c(Na+)> c(C2O42-)> c(HC2O4-) |
铜合金及铜的氯化物在生产生活中有着广泛的应用。请回答下列问题:
(1)向硫酸铜、氯化钠混合溶液中滴加亚硫酸钠溶液生成CuCl沉淀,实验测得溶液的pH与亚硫酸钠溶液体积的关系曲线如图所示。
①用离子方程式解释亚硫酸钠溶液呈碱性的原因: 。
②用离子方程式解释图像中V<a时溶液酸性增强的原因: 。
当V>a时,随着亚硫酸钠溶液的体积增大,溶液pH增大的原因是 。
(2)已知:Ksp(AgCl)=8×10-10,Ksp(CuCl)=1.2×10-6。向CuCl 浊液中滴加硝酸银溶液,发生反应CuCl(s)+Ag+(aq) AgCl(s)+Cu+(aq),该反应平衡常数K= 。
AgCl(s)+Cu+(aq),该反应平衡常数K= 。
(3)硫酸铜溶液中含少量硫酸铁,加入氢氧化铜,过滤,除去三价铁离子,写出加入氢氧化铜时发生反应的离子方程式: 。
(4)测定CuCl和CuCl2混合物中CuCl含量的原理为用氯化铁溶液溶解样品,以邻菲罗啉作指示剂,用Ce(SO4)2溶液滴定至终点,滴定反应为Ce4++Fe3+=Fe2++Ce3+。氯化铁与氯化亚铜反应的离子方程式为 。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=
mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1),可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
I常温下,浓度均为0.1molL-1六种溶液的PH如表所示:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
Na2SO4 |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
7.0 |
请回答下列问题:
(1)上述盐溶液中的阴离子,结合质子的能力最强的是 。
(2)将CO2气体通入 饱和的碳酸钠溶液中,可以观察到的现象为 (结合离子方程式加以描述)。
(3)要增大氯水中的HClO的浓度,可向氯水中加入少量的碳酸钠溶液,用离子方程式解释原因 。
II、已知:25ºC时,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,酸碱按体积比为1:10混合后溶液显中性,则a+b= 。
(2)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
(1)在25℃条件下将pH=10的氨水稀释10倍后溶液的pH为(填序号)________。
A.9 B.11 C.9~10之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,溶液pH_________(填“增大”、“减小”或“不变”),主要原因是________________。
(3)已知某溶液中只存在NH4+、H+、OH-、Cl-四种离子,该溶液中各离子浓度大小顺序可能有如下几种关系:
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
①上述离子浓度大小关系不可能的是_________(填序号)。
②若溶液中只溶解了一种溶质,则该溶质是____________,上述离子浓度大小顺序关系中正确的是(选填序号)________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) ________ c(NH3·H2O)(填>、<或=)
(4)25℃时,如果将0.1molNH4Cl和0.05molNaOH溶于水,形成混合溶液,(假设无气体逸出损失),则NH4+和NH3·H2O两种粒子的物质的量之和等于________mol。
I.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
①从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”或“中”),这说明 。
②在Na3PO4溶液中,c(Na+)/c(PO43—) 3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:
5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O。下图是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率 。
II. 在某温度下,把1.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图像如下:
①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)= 。(用含有a、b的式子表示)
I. 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
| 酸 |
电离平衡常数K |
| CH3COOH |
1.76×10-5 |
| H2CO3 |
K1=4.3×10-7 K2=5.61×10-11 |
| H3PO4 |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
回答下列问题:
(1)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(2)等浓度的下列溶液中由水电离出的OH-浓度由大到小的顺序是__(用序号作答)
①CH3COONa ②NaH2PO4 ③NaHPO4 ④NaHCO3 ⑤Na2CO3
(3)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的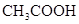 的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH=_____。
的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH=_____。
II.已知t℃时,Kw=1×10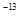 ;在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=________。
;在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=________。
III.现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
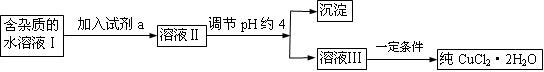
25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
4.7 |
| 完成沉淀pH |
3.2 |
9.7 |
6.7 |
请回答下列问题:
(1)流程中加入的试剂a最合适的是_____________(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是 。
(2)调节pH约4应该加入的物质可以是 。
A.CuO B.CuCl2 C.Cu(OH)2 D.NaOH
利用平衡移动原理简述加入该物质的理由 。
(3)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(若能,此空不填) 。
(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
| 酸 |
电离平衡常数K |
 |
 |
 |
  |
 |
   |
回答下列问题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”、“不变”)。
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是________________;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因_________________________。
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的 的电离转化率为____,则该温度下醋酸的电离平衡常数
的电离转化率为____,则该温度下醋酸的电离平衡常数 _____。
_____。
(二)化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。
(1)写出SOCl2和水反应的化学方程式:_____________________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是 ;用SOCl2与AlCl3·6H2O混合共热得到无水AlCl3,原因是________________________ 。
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__ ___0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断
(NH4)2CO3溶液的pH 7 (填>、<、=);
(4)将相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列 (填序号)
常温下,ZnS的溶度积常数Ksp=1.20×10-23 ,H2S的电离常数K1=1.32×10-7 K2=7.10×10-15 回答下列问题:
(1)K1>>K2的原因是
(2)0.1 mol/L H2S溶液中氢离子的物质的量浓度是 (填字母)
| A.等于0.1mol/L | B.等于0.2mol/L |
| C.小于0.1mol/L | D.在0.1~0.2mol/L之间 |
(3)0.1mol/LNa2S 溶液能使pH试纸变蓝,表明该现象的离子方程式是
(4)已知0.1mol/LNaHS溶液的pH约为9,则0.1mol/LNaHS溶液中各离子浓度由大到小的顺序是 。该溶液中的质子守恒关系式为
。
(5)向0.01mol/L的ZnCl2溶液中通入H2S(g)至饱和(c(H2S)按0.1mol/L计),为保证不产生ZnS沉淀,应控制c(H+)不低于 mol/L(已知7.811/2 =2.8)
化学反应原理是中学化学学习的重要内容。请回答下列问题:
(1)下列判断正确的是______________。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH2
则ΔH1﹤ΔH2
②H2(g)+ O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
则ΔH1﹤ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1﹤Q2
④CaCO3(s)===CaO(s)+CO2(g)ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s)ΔH2
则ΔH1﹤ΔH2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)
设计的原电池如图所示。

请回答下列问题:
①铜电极发生的电极反应为_____________________。
②溶液中Cu2+向________极移动。
(3)在一恒温、恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。

回答下列问题:
①Y的化学式是 。
②反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率,v(H2)= mol·L-1·min-1。
③能证明该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积分数保持不变 |
| B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) |
| D.混合气体的平均相对分子质量不变 |
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(4)室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如下图所示。下列有关溶液中离子、分子浓度大小关系的描述中正确的是____________。
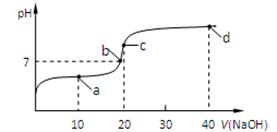
①.a点时:c(CH3COOH) >c(CH3COO-) > c(Na+) > c(H+) >c(OH-)
②.b点时:c(Na+)=c(CH3COO-) >c(H+) =c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)> c(CH3COO-) > c(OH-) >c(H+)
常温下,如果取0.1mol·L-1HCl溶液与0.1mol·L-1MOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=5,请回答下列问题:
(1)混合后溶液的pH=5的原因(用离子方程式表示):
(2)混合溶液中由水电离出的H+浓度是0.1mol·L-1HCl溶液中由水电离出的H+浓度的 倍。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Cl-)-c(M+)= mol·L-1,c(H+)-c(MOH)= mol·L-1。
(4)已知CH3COOM溶液为中性,HF常温下电离常数为6.8×10-4,CH3COOH电离常为1.7×10-5。
则MF溶液的pH 7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
| A.MHCO3 | B.CH3COOM | C.MClO | D.MCl |
按pH由小到大的顺序排列: (填序号)。
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。
已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式:
。
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H= kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为___________________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=_____________________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” ,下同)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-).
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(7分)按要求回答下列问题:
(1)向CH3COOH水溶液中加入水,平衡CH3COOH  H++CH3COO—将向 (填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比 (填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比 (填“增大”、“减小”或“不变”)。
H++CH3COO—将向 (填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比 (填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比 (填“增大”、“减小”或“不变”)。
(2)K通常表示化学平衡常数,对于反应Cl2+ H2O H++Clˉ+HClO其化学平衡常数K的表达式为: 。
H++Clˉ+HClO其化学平衡常数K的表达式为: 。
(3)下列说法中正确的是 。
| A.pH=1和pH=2的盐酸,c(H+)之比为1︰2 |
| B.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系不可能为c(Cl-) > c(H+) > c(NH4+)>c(OH一) |
| C.0.1 mol·L-1的NaHCO3溶液中: c(Na+)>c(HCO3-) >c(CO32-) >c (H2CO3) |
| D.升高温度,弱电解质的电离常数一定增大 |
E.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示。II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b