(8分)现有室温的①HCl ②H2SO4 ③CH3COOH三种溶液。
(1)若三种酸均为pH=2的溶液,它们的物质的量浓度由大到小的顺序是___________(用序号表示,下同),三种酸溶液各取1mL,分别加水到1000mL,pH最小的是________。
(2)若三种酸均为0.1mol·L-1的溶液,它们的pH由大到小的顺序是________,三种酸溶液各取1mL,分别加水稀释到1000mL,pH最小的是_________。
泡沫灭火剂包括 溶液(约1mol/L)、
溶液(约1mol/L)、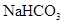 溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是______________________________.
溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是______________________________. 溶液和
溶液和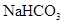 溶液的体积比约是____________.若用等体积、等浓度(mol/L)的
溶液的体积比约是____________.若用等体积、等浓度(mol/L)的 代替
代替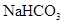 液,在使用时喷不出泡沫,这是因为________________________.
液,在使用时喷不出泡沫,这是因为________________________.
泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢钠溶液,不能把硫酸铝溶液盛在铁筒里的原因是___________________________________.
在室温下,0.1 mol·L-1CH3COONa溶液的pH=8,试精确表达下列算式的数学结果(填具体数字):
⑴c (Na+) -c (CH3COO-)=___________mol·L-1;
⑵c (OH-) -c (CH3COOH)=_________________mol·L-1
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ; 实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): ________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
(8分)现有S2-、SO32-、NH4+、Al3+、、Na+、SO42-、Fe3+、HCO3-、Cl-等离子,请按要求填空:
(1)在水溶液中,该离子水解呈碱性的是 。
(2)在水溶液中,该离子水解呈酸性的是 。
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有 。
(4)既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有 。
(12分)(1)氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是白色沉淀转变为红褐色沉淀。产生该现象的原因是 。
(3)25℃,向100mL pH=12的NaOH溶液加入pH=10的NaOH溶液1000 mL,混合后溶液体积1100 mL ,pH= 。
(4)常温下,将0.1000 mol L-1 NaOH溶液滴入20.00 mL 0.1000 mol L-1的一元弱酸HA溶液中,刚好完全反应,则c(Na+) c(A-)。(填“>”、“<”或“=”)
(5)某有机物结构为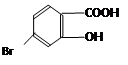 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。
物质在水中可能存在电离平衡、盐的水解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1mol•L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 。
(2)B为0.1 mol•L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(分别用离子方程式表示): ;实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;将B和C溶液混合后,反应的离子方程式为 。
(1)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,热化学方程式为
(2)已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成液态水放出571.6kJ的热量,表示氢气燃烧热的热化学方程式是
(3)Na2CO3等溶液不能存放在磨口玻璃塞的试剂瓶中,其原因是(结合离子方程式说明): ;把三氯化铁溶液蒸干并充分灼烧,最后得到的固体产物是(化学式) ;相关反应的方程式是: 、 ;配制FeCl2溶液时,应加入 ,以抑制Fe2+的水解,还应加入少量铁粉,目的是: 。
有下列四种溶液(均无气体逸出)
| A.0.01mol/L的H2CO3溶液 |
| B.0.01mol/L的NaHCO3溶液 |
| C.0.02mol/L的HCl与0.04mol/L的NaHCO3溶液等体积混合液 |
| D.0.02mol/L的NaOH与0.02 mol/L的NaHCO3溶液等体积混合液 |
据此,填写下列空白(填代号)
(1) c(H+) 最大的是______________; (2) c(H2CO3) 最大的是______________;
(3) c(HCO3-) 最大的是____________;(4) c(CO32-) 最大的是_____________;
(5) c(HCO3-) 最小的是____________。
某二元酸(化学式用H2A表示)在水中的电离方程式是(第一步电离完全):
H2A ="=" H+ + HA- HA- H+ + A2-
H+ + A2-
回答下列问题:
(1)Na2A溶液显____________(填“酸性”、“中性”、“碱性”)
理由是:(用离子方程式表示)__________________________________________。
(2)0.1mol/L的H2A溶液的pH_________1(填“<”“=”“>”)
(3)0.1mol/L的Na2A溶液中,下列微粒浓度关系错误的是_____________。
| A.c(Na+) =2c(A2-) =" 0.2" mol/L |
| B.c(OH-) = c(H+) + c(HA-) |
| C.c(Na+) + c(H+) = c(OH-) + c(HA-) + 2c(A2-) |
| D.c(Na+) =" 2c" (A2-) + 2c (HA-) |
依据题目要求回答下列问题。
(1)常温下,浓度均为0.lmol·L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合H+能力最强的是
②根据表中数据,浓度均为0.0lmol·L-1的下列五种物质的溶液中,酸性最强的是 (填编号);将各溶液分别稀释100倍,pH变化最小的是 (填编号)
③据上表数据,请你判断下列反应不能成立的是 (填编号)

④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下 。又知常温下某CuSO4溶液里
。又知常温下某CuSO4溶液里
02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于____.
(3)已知可逆反应 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
①写出该反应平衡常数的表达式:____ 。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度 (选填“增大”“减小”或“不变”);当 ,混合气体平均相对分子质量为 。
,混合气体平均相对分子质量为 。
常温下,取0.2 mol/L HA溶液与0.2 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合后的溶液中由水电离出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(2)已知NH4A溶液显中性,又知将HA溶液加到NaHCO3溶液中有气体放出,试推断NH4HCO3溶液的pH________7(填“>”、“<”或“=”)。
(3)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl |
按pH由大到小的顺序排列__________________(填字母序号)。
(用化学用语及必要的文字回答)
(1) 配制碳酸钾溶液要加少量的__ ___,原因是____ 。
(2)FeCl3溶液蒸干并灼烧得到的固体是___ __,原因是______ 。