常温下,下列关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl−) + c(ClO−) + c(OH−) |
| B.pH = 8.3的NaHCO3溶液:c(Na+)>c(HCO3−)>c(CO32−)>c(H2CO3) |
| C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH−) = c(CH3COO−) – c(CH3COOH) |
| D.向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4) |
下列有关溶液中微粒浓度关系的叙述正确的是
| A.0.1 mol·L-1NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3—)+c(H2CO3)+c(CO32—) |
| C.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| D.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)=c(NH4+)=c(Cl-) |
常温下,用NaOH溶液滴定20.00mL0.1 mol•L-1CH3COOH溶液所得滴定曲线如图,下列说法正确的是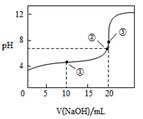
| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) ="=" 2c(H+) + c(CH3COOH)
D.0.1 mol/L的NaHA溶液,其pH = 4:c(HA-)>c(H+)>c(H2A)>c(A2—)
用0.10 mol/L 的盐酸滴定0.10 mol/L 的氨水,滴定过程中不可能出现的结果是
A.c(NH4+)>c(Cl ),c(OH ),c(OH )>c(H )>c(H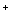 ) ) |
B.c(NH4+) = c(Cl ),c(OH ),c(OH ) = c(H ) = c(H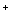 ) ) |
C.c(Cl )>c(NH4+),c(OH )>c(NH4+),c(OH )>c(H )>c(H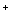 ) ) |
D.c(Cl )>c(NH4+),c(H )>c(NH4+),c(H )>c(OH )>c(OH ) ) |
常温下,0.2mol·L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
A.NaHA溶液显酸性
B.混合溶液中水电离出的C(OH-)、C(H+)相等
C.图中X、Y、Z分别代表OH-、HA-、H+
D.混合溶液中:C(Na+)= C(H2A)+ C(HA-)+ C(A2-)
对下列电解质溶液的叙述错误的是
| A.等物质的量浓度的Na2CO3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B.25℃时,0.2 mol·L-1盐酸与等体积0. 05 mol.L-lBa(OH)2溶液混合后,溶液的pH=l |
| C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| D.25℃时,若0.3 mol.L-1 HY溶液与0.3 mol.L-l NaOH溶液等体积混合后,溶液的 pH=9,则:c(OH-)一c(HY)=1×l0-9 mol.L-1 |
下列叙述正确的是
| A.0.1 mol/L氨水中c(NH4+)=c(OH-) |
| B.等体积等物质的量浓度的CH3COOH和NaOH溶液混合后 c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C.pH=2的HA溶液和pH=12的MOH溶液以任意比混合的溶液中 c(H+)+c(M+)=c(OH-)+C(A-) |
| D.常温下,pH=7的氯化铵与氨水的混合溶液中 |
c(C1-)>c(NH4+)>c(H+)=c(OH-)
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
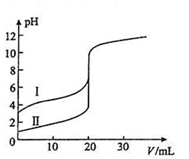
| A.Ⅰ表示的是滴定盐酸的曲线 |
| B.PH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| C.V(NaOH) =20ml时,C(Cl— )="=" C(CH3COO— ) |
| D.V(NaOH) =10ml时,醋酸溶液中:C(Na+ )> C(CH3COO— )> C(H+ )> C(OH— ) |
常温下,下列溶液中的微粒浓度关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO)>c(CO)>c(H2CO3) |
| C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH)>c(OH-)=c(H+) |
| D.0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合: |
2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
已知①CH3COOH与CH3COONa等物质的量混合配成的稀溶液,pH为4.7;②用等物质的量的HCN和NaCN配成的稀溶液中,c(CN-) < c(Na+),则下列说法不正确的是
| A.CH3COONa的水解趋势大于CH3COOH的电离趋势 |
| B.NaCN的水解趋势大于HCN的电离趋势 |
| C.②溶液中,c(H+)<c(OH-) |
| D.CH3COONa的存在抑制了CH3COOH的电离 |
pH=1的无色溶液中,可大量共存的一组离子是( )
| A.Fe2+、Na+、NO3-、SO42- | B.Cu2+、NH4+、SO42-、CO32- |
| C.Ba2+、Na+、Cl-、ClO- | D.Al3+、K+、NO3-、Cl- |
常温下,用0.1000 mol/L HCl溶液滴定 20.00 mL 0.1000 mol/L NH3•H2O,溶液滴定曲线如下图。下列说法正确的是
| A.点①溶液中:c(C1—) >c(NH4+)>c(OH—) >c(H+) |
| B.点②溶液中:c(NH4+)>c(C1—)>c(OH—)>c(H+) |
| C.点③溶液中:c(C1—)>c(H+)>c(NH4+)>c(OH—) |
| D.滴定过程中可能出现: c(NH3•H2O)>c(NH4+)>c(OH—)>c(Cl—)>c(H+) |
已知某酸H2B在水溶液中存在下列关系:①H2B H++HB-,②HB-
H++HB-,②HB- H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
D.c(Na+)=c(HB-)+c(B2-)+c(H2B)