室温下,将0.05固体溶于水配成100
溶液,向溶液中加入下列物质。有关结论正确的是
| 加入的物质 |
结论 |
|
| A |
50 |
反应结束后, |
| B |
0.05 |
溶液中 |
| C |
50 |
由水电离出的 |
| D |
0.1 |
反应完全后,溶液 |
Na2CO3溶液中存在水解平衡:CO32-+H2O  HCO3-+OH-。下列说法错误的是
HCO3-+OH-。下列说法错误的是
| A.加水稀释,溶液中所有离子的浓度都减小 | B.通入CO2,溶液pH减小 |
C.加入NaOH固体,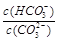 减小 减小 |
D.升高温度,平衡常数增大 |
25 ℃时,在25 mL 0.1 mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,溶液的pH变化如下图所示,下列分析的结论中正确的是( )
A.B点的横坐标a=12.5
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.曲线上A、B间的任意一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
常温下,将等体积,等物质的量浓度的与
溶液混合,析出部分
晶体,过滤,所得滤液
。下列关于滤液中的离子浓度关系不正确的是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|
25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是
| A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+) |
| B.在B点:c(Na+) ﹦c(CH3COO-) ﹥c(OH-)﹦c(H+), |
| C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-) |
| D.在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+) |
对于0.1 mol·L-1 Na2SO3溶液,正确的是
| A.升高温度,溶液pH降低 |
| B.c(Na+) = 2c(SO32-) + c(HSO3-) + c(H2SO3) |
| C.c(Na+) + c(H+) =2c(SO32-) + 2c(HSO3-) + c(OH-) |
| D.加入少量NaOH固体,c(SO32-)与c(Na+)均增加 |
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25 ℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、电离度均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是
| A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
| B.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) |
| C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
| D.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
室温下,下列混合溶液中,各离子浓度的关系正确的是( )
| A.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合: 2c(CO32-)+c(OH-)+c(HCO3-)—c(H+)=0.1mol·L-1 |
| B.浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合 c(SO42-)>c(Na+)>c(NH4+)>c(H+)>c(OH-) |
| C.pH=12的氨水与pH =2的盐酸等体积混合 c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.浓度均为0.1mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合 |
c(Na+)=c(CH3COO-)>c(OH—)=c(H+)
下列说法错误的是
| A.常温下,若醋酸钠与醋酸的混合溶液pH=7,则C(Na+)=c(CH3COO-) |
| B.某温度下,pH=6的NaCl溶液中离子浓度的大小关系:c(Na+)= c(Cl-)>c(H+)>c(OH-) |
| C.若2a mol·L-1HCN与a mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则混合溶液pH>7 |
| D.含0.1 mol NaHCO3和0.2molNa2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—) |
下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且 3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后: c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12, |
则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合: c(Na+)=c(Cl-)>c(CH3COO-)>c(H+) |
| B.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7): c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-) |
C.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合: c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸): |
2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中不正确的是(忽略混合前后溶液体积变化)…………………( )
| A.溶液的pH值:②>③>① |
| B.水电离出的c(OH-):③>①>② |
| C.①和②等体积混合后的溶液:c(CH3COOH)+ c(CH3COO-)=0.1mol/L |
| D.②和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(CH3COO-) |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
A.H2A在水中的电离方程式是:H2A===H++HA-、HA- H++A2-
H++A2-
B.当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)