下列说法正确的是( )
| A.向0.1 mol·L-1 KNO3溶液中滴加稀盐酸使溶液的pH=5,此时混合液中c(K+)<c(NO3―) |
| B.25 ℃时,0.1 mol·L-1氨水和0.05 mol·L-1氨水中c(OH―)之比是2∶1 |
| C.0.1 mol·L-1NH4Cl溶液中c(Cl―)=c(NH4+) |
| D.向CH3COONa溶液中加入适量CH3COOH使混合液pH=7,此时溶液中c(Na+)=c(CH3COO―) |
下列大小比较正确的是
| A.常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,溶液中c(Na+)大于c(Cl-) |
| B.25℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水中水的电离程度 |
| C.0.1 mol·L-1(NH4)2CO3溶液中的c(NH)大于0.1 mol·L-1的NH4Cl溶液中的c(NH)的2倍 |
| D.等体积、等物质的量浓度的NaCl(aq)离子总数小于NaClO(aq)中离子总数 |
常温下,用0.1000 mol·L-1 HCl溶液滴定20.00 mL 0.1000 mol·L-1 NH3·H2O溶液,滴定曲线如下图。下列说法正确的是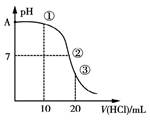
| A.A点的PH=13 |
| B.②溶液: c(NH4+) > c(Cl-)>c(OH-)=c(H+) |
| C.③溶液:此时溶液中的水电离的c(H+)比原氨水中水电离的c(H+)小 |
| D.滴定过程中可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)> c(Cl-)> c(H+) |
下列叙述正确的是
| A.95 ℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.0.2 mol·L-1的盐酸与等体积水混合后pH = 1(忽略体积的变化) |
| C.pH = 3的醋酸溶液稀释至10倍后pH = 4 |
| D.Na2CO3溶液中:c(Na+) + c(H+) = c(HCO3-) +c(CO32-) + c(OH-) |
下列说法正确的是
| A.100℃时,Kw=10-12,此温度下pH=6的溶液一定显酸性 |
B.25℃时,0.1 mol/L的NaHSO3溶液pH=4,说明 在水溶液中只存在电离平衡 在水溶液中只存在电离平衡 |
| C.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 |
| D.25℃时,10 mL0.1 mol/LCH3COOH溶液与5 mL0.1 mol/LNaOH溶液混合,所得溶液中有2c(Na+)=c(CH3COO-)+c(CH3COOH) |
25oC时,向25mL 一定浓度的 NaOH溶液中逐滴加入某浓度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的体积关系曲线如图所示。下列有关混合溶液说法错误的是
A.A、B间的溶液中可能有:c(Na+) > c(CH3COO-) > c(OH-) >c(H+)
B.B点: c(CH3COO-)=c(Na+)>c(OH-)=c(H+)
C.C点: c(CH3COO-)> c(Na+)> c(H+) > c(OH-)
D.NaOH溶液和醋酸溶液的浓度都恰好为0.1 mol·L-1
现有a mol/L NaX和bmol/L NaY两种盐溶液。下列说法正确的是
| A.若a=b且c(X-)=c(Y-)+c(HY),则酸性HX>HY |
| B.若a>b且c(X-)=c(Y-),则酸性HX<HY |
| C.若a=b且pH(NaX)>pH(NaY),则酸性HX>HY |
| D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则a=b=0.1mol/L |
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
| 化学式 |
电离常数 |
| HClO |
K=3×10-8 |
| H2CO3 |
K1=4.3×10-7 |
| K2=5.6×10-11 |
 A.c(HCO3-)>c(ClO-)>c(OH-)
A.c(HCO3-)>c(ClO-)>c(OH-) B.c(ClO-)>c(HCO3-)>c(H+)
B.c(ClO-)>c(HCO3-)>c(H+) C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3-)  D.c(Na+)+c(H++H)=c(HCO3-)+c(ClO-)+c(OH-)
D.c(Na+)+c(H++H)=c(HCO3-)+c(ClO-)+c(OH-)
已知25℃时,弱电解质的电离平衡常数:Ka(CH3COOH) ,Ka(HSCN)
,Ka(HSCN) 。在物质的量浓度均为
。在物质的量浓度均为 mol·L
mol·L 的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
A.c(OH )>c(CH3COOH)>c(HSCN)>c(H )>c(CH3COOH)>c(HSCN)>c(H ) ) |
B.c(OH )>c(HSCN)>c(CH3COOH)>c(H )>c(HSCN)>c(CH3COOH)>c(H ) ) |
C.c(OH )>c(SCN )>c(SCN )>c(CH3COO )>c(CH3COO )>c(H )>c(H ) ) |
D.c(OH )>c(CH3COO )>c(CH3COO )>c(SCN )>c(SCN )>c(H )>c(H ) ) |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+) |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C.已知叠氮酸(HN3)与醋酸酸性相近,则在NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(OH¯)>c(N3¯)>c(H+) |
| D.0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
常温下,用0.1000 mol/L HCl溶液滴定20.00 mL 0.1000 mol/L NH3•H2O溶液,滴定曲线如下图。下列说法正确的是
| A.①溶液:c(C1—)>c(NH4+)>c(OH—)>c(H+) |
| B.②溶液:c(NH4+)=c(C1—)>c(OH—)=c(H+) |
| C.③溶液:c(H+)>c(NH3·H2O) + c(OH—) |
| D.滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH—)>c(Cl—)>c(H+) |
已知两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB)。下列有关说法正确的是
A.等温浓度均为0.1 mol·L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB)
B.在0.1mol·L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+)
C.等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多
D.等温浓度均为0.1 mol·L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB)
某研究小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O NH4HCO3+NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是
NH4HCO3+NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是
| A.0~12 min,初始浓度越大的实验,水解反应速率越大 |
| B.c(NH2COO-)将随反应时间的不断延长而一直减小至0 |
| C.25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1 |
| D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1 |
下列有关溶液中微粒的物质的量浓度的关系,正确的是
A.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液:c(Cl-)>c(Na+)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c( )
)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(OH-)+c(H2A)=c(H+)+2c(A2-)
下列有关离子浓度的比较正确的是的
A. 0.1mol·L—1氨水中,c(OH—)<c(NH4+)
B. 10mL 0.02mol·L—1HCl溶液与10mL 0.02mol·L—1Ba(OH)2溶液充分混合, c(Cl-)>c(Ba2+)>c(OH-)=c(H+)
C. 将0.1mol·L—1CH3COONa和0.1mol·L—1NH4Cl等体积混合后的溶液中,c(H+)+c(CH3COOH) >c(NH3·H2O)+c(OH—)
D. 0.1mol·L—1某二元弱酸碱性NaHA溶液中,c(H+) +c(H2A)=c(A2—)+c(OH—)