欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO )、c(HCO3-)都减少,其方法是
)、c(HCO3-)都减少,其方法是
| A.通入二氧化碳气体 | B.加入饱和石灰水溶液 |
| C.通入氯化氢气体 | D.加入氢氧化钠固体 |
下列溶液中有关物质的浓度关系正确的是( )
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中: c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl) |
| B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
用物质的量均是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是( )
| A.c(CH3COOH)>c(CH3COO-) | B.c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 |
| C.c(H+)>c(OH-) | D.c(CH3COO-)+c(OH-)=0.1 mol·L-1 |
25℃时,若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A.生成了一种强酸弱碱盐 | B.弱酸溶液和强碱溶液反应 |
| C.强酸溶液和弱碱溶液反应 | D.一元强酸溶液和一元强碱溶液反应 |
三种常见的酸(或碱)在水溶液中的电离情况如下表,下列说法正确的是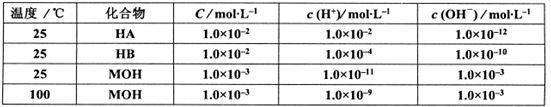
| A.温度相同,物质的量浓度也相同的MA和MB溶液,前者pH大于后者 |
B.pH相同的HA和HB的溶液中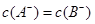 |
| C.相同浓度的MOH溶液,溶液的碱性随温度的升高而减弱 |
| D.25℃时MOH抑制水的电离,100℃时MOH促进水的电离 |
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。
下列有关说法正确的是
| A.a点由水电离出的c(H+)=1.0×10-14mol/L |
| B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)= c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
下列各离子浓度的大小比较,正确的是
| A.同浓度的下列溶液中:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,c(NH+4)由大到小的顺序是:①>③>② |
| B.常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH+4)>c(Cl-) |
| C.0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D.0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
室温时,将浓度和体积分别为 、
、 的NaOH溶液和
的NaOH溶液和 、
、 的
的 溶液相混合,下列关于该混合溶液的叙述错误的是( )
溶液相混合,下列关于该混合溶液的叙述错误的是( )
A.若PH>7,则一定是 |
B.在任何情况下都是 |
C.当pH=7时,若 ,则一定是 ,则一定是 |
D.若 , , ,则 ,则 |
下列判断不正确的是
①若NaA、NaB溶液的pH分别为9和8,则酸性一定是HA<HB;
②FeCl3溶液蒸干得FeCl3固体,Na2CO3溶液蒸干得Na2CO3固体;
③CH3COONa水解产生CH3COOH和OH-,向水解液中加入少量冰醋酸会因其中和OH-而使水解平衡右移;
④因Fe3++3H2O Fe(OH)3+3H+,为抑制水解,配制FeCl3溶液时需将FeCl3溶解在稀H2SO4中;
Fe(OH)3+3H+,为抑制水解,配制FeCl3溶液时需将FeCl3溶解在稀H2SO4中;
⑤中和pH和体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
A.只有①② B.只有②③⑤ C.只有①②③⑤ D.全部
下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c( )、c(H+)均下降 )、c(H+)均下降 |
B.常温下,c(N )相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ )相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
D.当溶液中存在的离子只有Cl-、OH-、 、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c( 、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
已知HA和HB都是弱酸,且常温下相同浓度的两种酸溶液中,HA溶液中的氢氧根的浓度大于HB溶液。下列叙述不正确的是
A.0.1 mol•L—1HA溶液中:c(H+)— c(OH-)=c(A-)
B.将pH=3的HB与pH=11的氢氧化钠溶液等体积混合后所得溶液显酸性
C.0.2 mol·L-1HB溶液与0.1 mol·L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(B—)-c(HB)
D.物质的量浓度均为0.01mol•L—1的NaA和NaB的混合溶液中:c(OH—)> c(HB)> c(HA)>c(H+)
将标准状况下2.24L CO2缓慢通入1L 0.15 mol•L—1的NaOH溶液中,气体被充分吸收,下列关系不正确的是
| A.c(Na+)+c(H+)=c(OH—)+c(HCO3—)+2c(CO32—) |
| B.2c(Na+)=3[c(H2CO3)+c(HCO3—)+c(CO32—)] |
| C.c(Na+) > c(CO32—) > c(HCO3—)> c(OH—)> c(H+) |
| D.2c(OH—)+ c(CO32—)= c(HCO3—)+ 3c(H2CO3)+2c(H+) |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断下列说法正确的是
| A.当y(NaOH)="20" mL时,溶液中离子浓度大小关系: c(Na+) >c(HA一)>c(H+)> c(A2- )>c(OH—) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.欲使NaHA溶液呈中性,可以向其中加入酸或碱 |
| D.向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
下列溶液中微粒的物质的量浓度关系正确的是
| A.Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+) |
| B.等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X-)>c(OH-)=c(H+) |
| C.常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中: c(Cl-)>c(NH4+)> c(NH3·H2O)>c(OH-)>c(H+) |
| D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中: |
c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)