室温下0.1mol/L的NH4CN溶液的pH等于9.32。下列说法错误的是
| A.上述溶液能使甲基橙试剂变黄色 |
| B.室温下,NH3·H2O是比HCN更弱的电解质 |
| C.上述溶液中CN-的水解程度大于NH4+的水解程度 |
| D.室温下,0.1mol/LNaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度 |
在CH3COONa溶液中,各种离子浓度从小到大的顺序是( )
| A.c(H+)<c(OH-)<c(CH3COO-)<c(Na+) |
| B.c(H+)<c(OH-)<c(Na+)<c(CH3COO-) |
| C.c(H+)<c(CH3COO-)<c(OH-)<c(Na+) |
| D.c(OH-)<c(CH3COO-)<c(H+)<c(Na+) |
将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+) > c (X- ),则下列关系正确的是:
| A.c (OH- ) < c (H+ ) | B.c (HX ) < c (X- ) |
| C.c (X- ) + c(HX )=" 2c" (Na+) | D.c (Na+ ) + c (HX) ="=" c( H+ ) +c (OH-) |
下列各方程式中,属于水解反应的是( )
A.CO2+H2O H2CO3 H2CO3 |
B.OH-+HS- S2-+H2O S2-+H2O |
C.HS-+H2O H3O++S2- H3O++S2- |
D.S2-+H2O HS-+OH- HS-+OH- |
某二元酸(简写为H2A)溶液,按下式电离: H2A=H++HA- HA-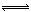 H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
A.溶液肯定不显中性,但显酸性还是碱性无法确定
B.常温下0.1mol/L的NaHA溶液的PH=2
C.溶液中c(Na+)=c(HA-)+ c(A2-)
D.溶液中c(Na+)>c(HA-)>c(A2-)>c(H+)
下列叙述正确的是
| A.将纯水加热,水的离子积变大、pH变小、溶液呈酸性 |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 |
| D.中和体积和pH都相等的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
水解原理在工农业生产、日常生活中具有重要用途。下列关于物质的用途,与盐类水解有关的是
| A.次氯酸钠常用作消毒剂 | B.FeCl3用于印刷线路板 |
| C.热的纯碱溶液用于清洗油污 | D.氯化钠是氯碱工业的重要原料 |
准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.10000 mol·L-1 NaOH溶液滴定,下列说法正确的是( )
| A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 |
| B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 |
| C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 |
| D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 |
实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需要浓度,如此操作的目的是
| A.防止硫酸铁分解 | B.抑制硫酸铁水解 |
| C.提高硫酸铁的溶解度 | D.提高溶液的PH |
物质的量浓度相同的三种正盐NaX、NaY、NaZ的水溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
| A.HX>HZ>HY | B.HZ>HY>HZ | C.HX>HY>HZ | D.HY>HZ>HX |
下列溶液:① CH3COOH ② HCl ③ NaOH ④ CH3COONa ⑤KCl ⑥NH4Cl其物质的量浓度均为0.1mol/L,其pH由大到小排列顺序为
| A.③④⑤⑥①② | B.④⑤⑥①③② |
| C.②①⑥⑤④③ | D.②③①⑥⑤④ |
下列推断合理的是
| A.在常温下,Na2SiO3+H2O+CO2 = Na2CO3+H2SiO3↓,说明H2CO3酸性强于H2SiO3; 在高温下,  ,说明H2SiO3酸性强于H2CO3 ,说明H2SiO3酸性强于H2CO3 |
| B.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液,则 c[(NH4)2SO4]>c[(NH4)2CO3] >c[(NH4)2Fe(SO4)2] |
| C.向1L0.3mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g时,则溶液中 2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)] |
| D.在海带中提取碘的实验中既可以用四氯化碳作萃取剂也可以用酒精作萃取剂 |