常温下,下列溶液中的离子浓度关系正确的是
| A.pH=3的醋酸溶液中:c(H+)=c(CH3COO-)="3.0" mol•L-1 |
| B.Na2S溶液中:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| C.pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ |
下列叙述不正确的是
A.0.1 mol•L-1氨水中,c(OH-)>c(NH4+)
B.等体积等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
C.在0.1 mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol•L-1某二元弱酸强碱盐Na2A溶液中,c(Na+)=2c(A2-)+2c(HA-)+2c(H2A)
已知0.1 mol•L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.物质的量浓度相等的Na2A、NaHA两溶液的pH相大小为前者小于后者
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
(12分)乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解。
(1)探究草酸的酸性
①已知:25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7 K2= 4.7×10-11
下列化学方程式正确的是
A.H2C2O4+CO32-= HCO3-+HC2O4- B.HC2O4-+CO32-= HCO3-+C2O42-
C.H2C2O4+CO32-= C2O42-+H2O+CO2 D.2C2O42-+CO2+H2O = 2HC2O4-+CO32-
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是 。
A.c(H2C2O4)>c(HC2O4-)
B.c(Na+)+c(H+)="2" c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-)
D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(2)用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度。
实验步骤:准确称取1gNa2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4 ,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
①高锰酸钾溶液应装在 滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是: 。
③下列操作可能使测量结果偏高的是
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算Na2C2O4的纯度
下列有关说法正确的是( )
| A.常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) |
| B.常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+) |
| C.常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)="0.1" mol/L: c(Na+) = c(CH3COOH) > c(CH3COO-) > c(H+) = c(OH-) |
D.常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中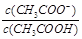 的值减小到原来的 的值减小到原来的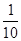 |
一定温度下,下列溶液的离子浓度关系式正确的是( )
| A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1 |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合: c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )

A.a点时溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH- Al(OH)3 Al(OH)3 |
| B.a~b段,溶液pH增大,Al3+浓度不变 |
| C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| D.d点时,Al(OH)3沉淀开始溶解 |
现有物质的量浓度均为 0.1 mol·L - 1 的四种溶液各25mL:①氨水 ②NH4Cl 溶液
③Na2CO3溶液 ④NaHCO3溶液,下列说法正确的是:
| A.4种溶液pH的大小顺序:①>④>③>② |
| B.①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3·H2O) |
| C.①、②中分别加入25mL 0.1 mol·L – 1盐酸后,溶液中c(NH4+):①>② |
| D.③、④中分别加入12.5mL 0.1 mol·L – 1NaOH溶液后,两溶液中离子种类相同 |
下列溶液中粒子的物质的量浓度关系正确的是:
| A.0.1 mol·L - 1 NaHC2O4溶液与0.1 mol·L – 1KOH溶液等体积混合,所得溶液中: c(Na+)>c(K+) >c(C2O42-) >c(OH-) >c(HC2O4-) |
| B.20mL 0.1 mol·L - 1NH4Cl溶液与10mL 0.1 mol·L - 1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl-)>c(NH4+) >c(Na+)>c(OH-)>c(H+) |
| C.常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中: c(Na+)+ c(OH-) >c(H+)+ c(F-) |
| D.0.1 mol·L – 1 NH3·H2O溶液与0.1 mol·L – 1 HNO3溶液等体积混合,所得溶液中: |
c(H+) >c(OH-) + c(NH3·H2O)
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
向300mL 1.0mol/L的NaOH溶液中通入标准状况下4.48LCO2气体,充分反应后,所得溶液中:
(1)离子浓度大小关系:
(2)电荷守恒:
(3)物料守恒:
(4)质子守恒:
将0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则:
(1)混合溶液中c(A-)________c(HA)(填“>”“<”或“=”,下同)。
(2)混合溶液中c(HA)+c(A-)________0.1 mol·L-1。
(3)混合溶液中,由水电离出的c(OH-)________0.2 mol·L-1 HA溶液中由水电离出的c(H+)。
(4)25 ℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度________NaA的水解程度。
HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
| A.c(Na+)>c(A-)>c(H+)>c(OH-) |
| B.c(Na+)>c(OH-)>c(A-)>c(H+) |
| C.c(Na+)+c(H+)=c(A-)+c(OH-) |
| D.c(Na+)+c(OH-)=c(A-)+c(H+) |
为了使Na2S溶液中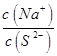 的比值变小,可采取的措施是
的比值变小,可采取的措施是
①适量盐酸 ②适量NaOH(s) ③适量KOH(s) ④适量KHS(s)
⑤加水 ⑥通H2S(g) ⑦加热
| A.③④ | B.①②⑤⑥⑦ | C.②③ | D.②③④ |
化学反应原理是中学化学学习的重要内容。请回答下列问题:
(1)下列判断正确的是______________。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH2
则ΔH1﹤ΔH2
②H2(g)+ O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
则ΔH1﹤ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1﹤Q2
④CaCO3(s)===CaO(s)+CO2(g)ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s)ΔH2
则ΔH1﹤ΔH2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)
设计的原电池如图所示。

请回答下列问题:
①铜电极发生的电极反应为_____________________。
②溶液中Cu2+向________极移动。
(3)在一恒温、恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。

回答下列问题:
①Y的化学式是 。
②反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率,v(H2)= mol·L-1·min-1。
③能证明该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积分数保持不变 |
| B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) |
| D.混合气体的平均相对分子质量不变 |
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(4)室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如下图所示。下列有关溶液中离子、分子浓度大小关系的描述中正确的是____________。
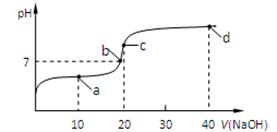
①.a点时:c(CH3COOH) >c(CH3COO-) > c(Na+) > c(H+) >c(OH-)
②.b点时:c(Na+)=c(CH3COO-) >c(H+) =c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)> c(CH3COO-) > c(OH-) >c(H+)