20℃时向20mL 0.1mol·L-1醋酸溶液中不断滴入0.1mol·L-1NaOH(aq),溶液pH变化如图所示。此过程里溶液中离子浓度的关系错误的是 
| A.a点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.b点:c(Na+) = c(CH3COO-)>c(H+) = c(OH-) |
| C.c点:c(H+) = c(CH3COOH) + c(OH-) |
| D.d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,下列是有关0.1mol/L醋酸钡溶液中粒子浓度的比较,其中错误的的是
| A.c(Ba2+) >c(CH3COO-)>c(OH-)>c(H+) |
| B.c(H+)+2c(Ba2+)= c(CH3COO-) +c(OH-) |
| C.c(H+) = c(OH-)-c(CH3COOH) |
| D.2c(Ba2+)= c(CH3COO-)+ c(CH3COOH) |
25℃时,下列说法正确的是
A.pH =8.3的NaHCO3溶液:c( Na+)>c( HC )>c(C )>c(C  )>c( H2CO3) )>c( H2CO3) |
| B.中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量不相同 |
| C.用一定浓度的NaOH溶液滴定氢氟酸,当pH =6时,溶液中c(F—)—c(Na+)=9.9×l0—7 mol/L |
| D.用NaOH溶液滴定HCI与CH3COOH的混合溶液至中性时,溶液中的酸被完全中和 |
25℃时,2a mol·L-1HA水溶液中(HA为弱酸)。用NaOH调节溶液pH(忽略体积变化),得到c(HA)、c(A-)与溶液pH的变化关系如下图所示。下列说法错误的是
A.当pH=3时,溶液中c(A-)>c(Na+)
B.当c(A-)>c(HA),溶液一定呈碱性
C.当pH=3.45时,c(Na+)+c(H+)=c(HA)+c(OH-)
D.当pH=4时,溶液中:c(HA)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1
在V mL 0.1 mol/L Na2S溶液中逐滴加入V mL 0. 1 mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是
| A.c(SO42-)= c(HS-) =c(K+) >c(OH-)=c(H+) |
| B.c(Na+)> c(K+)> c(S2-)> c(H+)>c(OH-) |
| C.c(Na+)= c(S2-)+ c(H2S)+c(HS-)+ c(SO42-) |
| D.c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-) |
下列各溶液中,微粒的物质的量浓度关系表述正确的是
| A.0.1 mol/LNa2CO3溶液中:c(Na+)=(HCO3-)+c(H2CO3)+2c(CO32-) |
| B.常温下pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 |
| C.将0.2mol/LNaA溶液和0.1 mol·L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.pH=l2的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 |
现有室温下四种溶液,有关叙述不正确的是
| 编号 |
① |
② |
③ |
④ |
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va + Vb),若混合后溶液
pH = 4,则Va : Vb =" 11" : 9
200mL0.1 mol·L-1CH3COOH与200mL0.1 mol·L-1NaOH溶液混合后,离子浓度关系正确的是
| A.c(Na+)=c(CH3COO-)+c(CH3COOH) |
| B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C.c(Na+)+c(OH-)= c(CH3COO-)+c(H+) |
| D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
| A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L |
| B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.c(OH-)=c(HY)=c(H+)=1×10-9 mol/L |
| D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L |
已知NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,则两溶液中各粒子物质的量浓度的关系一定正确的是(R表示S或C)
A.c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-)
B.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
C.c(Na+)>c(HRO3-)>c(H+)>c(OH-)>c(RO32-)
D.c(HRO3-)>c(H2RO3)>c(OH-)>c(RO32-)>c(H+)
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) → 2AlCl3 + 3H2。
完成下列填空: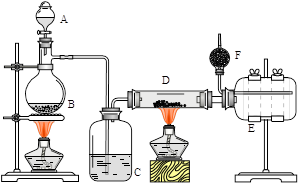
(1)写出B处烧瓶中发生反应的化学方程式:_______________________________________。
(2)C中盛有的试剂为__________。进行实验时应先点燃_____(选填“B”或“D”)处酒精灯。
(3) 用粗短导管连接D、E的目的是_________(选填序号)。
a. 防堵塞 b. 防倒吸 c. 平衡气压 d. 冷凝回流
E瓶的作用是_______________________________________________________。
(4)F中盛有碱石灰,其目的是_________(选填序号)。
a. 吸收HCl b. 吸收Cl2 c. 吸收CO2 d. 吸收H2O
(5)①将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是_____________________________________________。
②若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为_______。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变,也能制备无水AlCl3。事实证明这样做比较危险,请简述理由 _________________________。
常温下,在l00mL 1mol/L 的NaHCO3溶液中,加入Xmol的Ba(OH)2固体(假设溶液体积和温度保持不变)。以下关于溶液中c(CO32-)及c(HCO3-)的变化判断正确的是
| A.当X=0.025时,溶液中有HCO3-和CO32-,且2C (CO32-) =" C(" HCO3-) |
| B.当X=0.05时,溶液中有HCO3-和CO32-,且C (CO32-)> C( HCO3-) |
| C.当X=0.06时,溶液中HCO3-、CO32-浓度都减小了 |
| D.当X=0.1时,溶液pH增大,沉淀达到最大值 |
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若溶液中c(A-)=c(Na+),则溶液一定呈中性
B.溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)
C.若c(OH-)> c(H+),溶液中不可能存在:c(Na+)> c(OH-)> c(A-)> c(H+)
D.若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)
25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.0.1 mol·L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
现有常温下的四份溶液:① 0.01mol/LCH3COOH;② 0.01mol/LHCl;③ pH=12的氨水;④ pH=12的NaOH溶液。下列说法正确的是
| A.①中水的电离程度最小,②③④中水的电离程度一样大 |
| B.将②③混合,若pH=7,则消耗溶液的体积:②<③ |
| C.将①、④混合,若有c(CH3COO¯)>c(H+),则混合液一定呈碱性 |
| D.将①、④等体积混合,所得溶液中一定有:c(OH¯)=c(H+) + c(CH3COOH) |