下列各溶液中,物质的量浓度关系正确的是
| A.0.1 mol•L—1的KAl(SO4)2溶液中:c(SO42—)>c(K+)>c(A13+)>c(H+)>c(OH—) |
| B.10mL0.01mo1•L—1HCl溶液与10mL0.01mo1•L—1Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 |
| C.在01mo1•L—1CH3COONa溶液中,c(OH—)=c(CH3COOH)+c(H+) |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液,若溶液呈酸性,则有c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—) |
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H 0(填“>”或“<”),上述反应体系中循环使用的物质是 。
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________,Na2S溶液中c(H+)+ c(Na+)=________________。
下列浓度关系正确的是
| A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) |
| B.0.1 mol/L的KOH溶液中通入标准状况下的CO2气体3.36 L,所得溶液中:c (K+)+c (H+)=c (CO32-)+c (HCO3-)+c (OH-) |
| C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+) |
| D.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3) |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+) >c(OH-)=c(H+) |
| D.0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 |
操作 |
现象 |
| I |
向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 |
溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ + SO32- +
SO32- + =
= F e2+ +
F e2+ + +
+

乙同学查阅资料得知:
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 |
操作 |
现象 |
| II |
用激光笔照射步骤I中的红褐色溶液 |
出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 |
操作 |
现象 |
| III |
向1 mol•L-1的FeCl3溶液中通入一定量的SO2 |
溶液由黄色变为红褐色 |
| IV |
用激光笔照射步骤III中的红褐色溶液 |
没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
室温下,0.01 mol/L 二元酸H2A溶液的pH= 3,下列说法正确的是
A.在Na2A,NaHA两种溶液中,离子种类相同
B.NaHA溶液的pH一定大于7
C.在NaHA溶液中一定有c(OH-)+ c(A2-) = c(H2A)+ c(H+)
D.在溶质的物质的量相等的Na2A,NaHA两种溶液中,阴离子总数相等
氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损。一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2 → Si3N4+12HCl
氮的氢化物肼(N2H4)是航天火箭发射常用的燃料,二氧化氮作氧化剂。
回答以下问题:
(1)氮原子的最外层电子排布式是_________________;氮元素有多种化合价,写出含2种价态氮的化合物的化学式_________________(举一例)。
(2)硅原子核外电子排布在______________种不同能量的电子亚层上,氮化硅属______________晶体。
(3)上述反应中,属于同一周期的元素符号有_________,用___________________________事实可以比较它们的非金属性强弱。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。NH3分子的空间构型是______________;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是_________(举一例)。
(5)肼作火箭发射燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l) → 3N2(g)+4H2O(g)+1038.7kJ若该反应中有4mol N-H键断裂,则形成的气体有_____mol,其中转移电子数目_____。
(6)肼能与硫酸反应生成N2H6SO4。该物质晶体类型与硫酸铵相同,则其溶液PH_______7(填>、<或=),原因是____________________(用离子方程式表示)
25℃时。有c(CH3COOH)+ c(CH3COO-)=0.1mol/L的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-) 与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述中正确的是。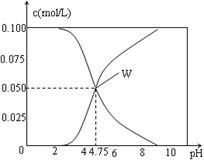
| A.pH=5.5的溶液中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.W点所表示的溶液中c(Na+) + c(H+)=c(CH3COO-)+c(OH-) |
| C.pH=3.5的溶液中:c(Na+) + c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L |
| D.向W点所表示的1L溶液中通入0.05molHCl气体(溶液的体积变化可忽略):c(H+)=c(OH-)+c(CH3COOH) |
25℃时,弱酸的电离平衡常数如下表,下列表述错误的是
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| K |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.CN-+H2O+CO2→HCN+HCO3-
B.相同温度时三种溶液的pH关系:Na2CO3> NaCN > CH3COONa
C.等体积、等物质的量浓度的CH3COOH和Na2CO3反应后的溶液呈碱性
D.amol/L HCN与bmol/L NaOH等体积混合溶液c(Na+)>c(CN-),则a一定小于b
常温下,向20.00mL 0.1000 mol (NH4)2 SO4溶液中逐滴加入0.2000 mol
(NH4)2 SO4溶液中逐滴加入0.2000 mol NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
下列说法正确的是
| A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C.点c所示溶液中:c(SO42)+ c(H+)= c(NH3·H2O )+ c(OH-) |
| D.点d所示溶液中:c(SO42)>c(NH3·H2O )>c(OH-)>c(NH4+) |
下列叙述正确的是
| A.0.1mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等 |
D.在NaHCO3溶液中:c(OH-)+c(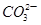 )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
下列说法正确的是
| A.0.1 mol/L溶液中的(NH4)2SO4,溶液中的c(NH4+)<c(SO42-) |
| B.相同温度下,0.6 mol/L氨水溶液与0.3 mol/l氨水溶液中c(OH-)之比是2:1 |
| C.向0.1 mol/LNaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D.向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)<c(CH3COO-) |
Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n( ): n(
): n( )变化的关系如下表:
)变化的关系如下表:
n( ): n( ): n( ) ) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+) < c (OH-)
B.Na2SO3溶液中c(Na+)> c ( )> c (
)> c ( ) > c (OH-) > c(H+)
) > c (OH-) > c(H+)
C.当吸收液呈中性时,c(Na+) >c ( ) > c (
) > c ( ) > c (OH-) = c(H+)
) > c (OH-) = c(H+)
D.当吸收液呈中性时,c(Na+)>c ( )+c (
)+c ( )
)
有0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |