下列各溶液中,微粒的物质的量浓度关系正确的是
| A.1.0 mol/L Na2CO3溶液:c(OH-) = c(HCO3-) + c(H+)+ 2c(H2CO3) |
| B.1.0 mol/L NH4Cl溶液:c(NH4+) = c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+) >c(CH3COO-)>c(H+)>c(OH-) |
| D.1 mol/L CH3COONa溶液,c(CH3COO-)=" 1" mol/L |
在相同温度下,等体积等物质的量浓度的4种稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含离子种类由多到少的顺序是
| A.①=④>③=② | B.④=①>③>② |
| C.①>④>③>② | D.④>①=③>② |
食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知: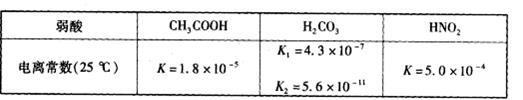
请回答下列问题:
(1)定温度下,向0.1 mol·L-1 CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号)。
a.溶液的pH增大
b.CH3COOH的电离程度增大
c.溶液的导电能力减弱
d.溶液中c(OH- ).c(H+)不变
(2)25℃时,0.10 mol·L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-):_____ mol·L-1。
(3)常温下,将20 mL 0.10 mol·L-1CH3COOH溶液和20 mL 0.10 mol·L-1HNO2溶液分别与20 mL 0.10 mol·L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH)_________v(HNO2)(填“>”、“<”或“:”),原因是_________.
②充分反应后.两溶液中c(CH3COO-)_________c(NO2-)(填“>”、“<”或“=”)。
(4)25 C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中
C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中 =__________。
=__________。
下列溶液中有关微粒的物质的量浓度关系正确的是
| A.常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):C(Na+)=c(HRO3-)+2c(RO32-) |
| C.常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③ |
| D.常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液②pH=3的HCl溶液③pH=11的氨水中由水电离出的c(H+):①>③>② |
下列叙述正确的是
| A.将FeCl3饱和溶液滴入沸水中可制得Fe(OH)3胶体 |
| B.AlCl3溶液和Al2(SO4)3溶液加热蒸干、灼烧都得到Al2O3 |
| C.向FeBr2溶液中通入过量Cl2 ,加CCl4振荡静置,上层液体无色、下层为橙红色 |
| D.将Cl2通入Na2SO3溶液中,检验是否有SO42-生成,可向该溶液中滴加足量盐酸酸化的Ba(NO3)2溶液 |
经测定某溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法错误的是
| A.溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-) |
| B.若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3·H2O,且溶液pH>7 |
| C.若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质可能是NH4Cl |
| D.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性 |
下列关于电解质溶液中离子关系的说法中正确的是
| A.0.1mol·L-1Na2CO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O等体积混合后离子浓度关系 c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合液溶中: c(Na+)=c(CH3COO-) |
| D.常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
下列溶液中微粒的物质的量浓度关系一定正确的是
| A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| B.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+) |
| C.等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-) |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+) ﹥ c(HCO3-) ﹥ c(CO32-) ﹥ c(H2CO3) |
| B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-) – c(H+) = c(HCO3-) + c(H2CO3) |
| C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液: c(CO32-) ﹥ c(HCO3-) ﹥ c(OH-) ﹥ c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)="0.1" mol·L-1]: |
c(Na+)= c(CH3COO-)> c(CH3COOH)>c(H+)=c(OH-)
下列排列顺序完全正确的组合是
①溶解性:Na2CO3>NaHCO3>MgCO3>Mg(OH)2
②等浓度的下列盐溶液的pH关系:NaAlO2>NaHCO3>NaClO
③常温下,以a1、a2、a3分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电离程度,则a1=a2>a3
④同温下,1L0.5mol/LNH4Cl溶液中n(NH4+)与2L 0.25mol/LNH4Cl溶液中n(NH4+),分别为a、b,则a>b
⑤热稳定性:H2O>H2Se>H2S
⑥半径:Cl->O2->Al3+;F<Si<Na
⑦氧化性:MnO2>Cl2>Fe3+>Cu2+
⑧沸点:金刚石>氯化钠>干冰>冰醋酸
| A.①②③④⑥ | B.①③④⑥⑦⑧ | C.②⑤⑧ | D.①④⑥⑦ |
常温下有浓度均为0.5mol・L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。该物质水解的离子方程式为 。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中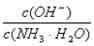 的值 (填“增大”或“减小”或“不变”)
的值 (填“增大”或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
25℃时,向10mL 0.01mol/L KOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的是
| A.pH>7时,c(C6H5O﹣)>c(K+)>c(H+)>c(OH﹣) |
| B.pH<7时,c(K+)>c(C6H5O﹣)>c(H+)>c(OH﹣) |
| C.V=10mL时,c(K+)=c(C6H5O﹣)>c(OH﹣)=c(H+) |
| D.V=20mL时,c(C6H5O﹣)+c(C6H5OH)=2c(K+) |
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是_______________(填序号);
(2)若溶液中只有一种溶质,则该溶质为__________,该溶液中离子浓度的大小关系为_______(填序号);
(3)若关系③正确,则溶液中溶质为_________;
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显_________(填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va__________Vb(填>、<、=、无法确定)。
I.25℃时,0.1mol•L﹣1的HA溶液中c(H+)/c(OH﹣)=1010.请回答下列问题:
①该HA溶液的pH等于 。
②在加水稀释HA的过程中,随着水量的增加而减小的是 (填字母)。
A.c(H+)/c(HA) B.c(HA)/c(A-) C.c(H+)·c(OH-) D.c (OH-)
③若M溶液是由上述HA溶液V1 mL与pH=12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是 (填字母)。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH﹣)=2.0×10﹣7 mol•L﹣1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2.
II.25℃时,有100mL 0.1mol/LNaHB溶液pH=1
(1)若向该溶液中加V1 mL水,使溶液pH变为2,则V1= mL (设溶液体积无变化)。
(2)25℃时此溶液和某浓度氨水pH之和为14,二者等体积混合后溶液中离子浓度由大到小的顺序为: 。
已知在常温下测得浓度均为0.1mol•L﹣1的下列四种溶液的pH如下表:
| 溶质 |
NaHCO3 |
Na2CO3 |
NaF |
NaClO |
| pH |
8.4 |
11.6 |
7.5 |
9.7 |
(1)用离子方程式表示NaClO溶液的pH = 9.7的原因 。
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的大小顺序为 。
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式: 。
(4)将CO2通入0.1mol•L﹣1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+ c(HCO3-)= mol•L﹣1