某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有 (填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有 。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:
a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
| |
选用试剂 |
实验现象 |
| 方案1 |
|
|
| 方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为 。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。下列说法中不正确的是( )。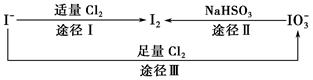
| A.用淀粉—KI试纸和食醋检验加碘盐时淀粉—KI试纸会变蓝 |
| B.足量Cl2能使湿润的、已变蓝的淀粉—KI试纸退色的原因可能是5Cl2+I2+6H2O=2HIO3+10HCl |
| C.由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA |
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+―→Cr3++Fe3++H2O ②。下列有关说法正确的是 ( )。
| A.还原性:Cr3+>SO2 |
| B.方程式②中,a=6,b=7 |
| C.Cr2O72-能将Na2SO3氧化成Na2SO4 |
| D.方程式①中W为OH- |
根据表中信息判断,下列选项不正确的是 ( )。
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4…… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4-…… |
Cl2、Mn2+…… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2
O3具有强氧化性,将O3通入KI溶液中发生反应:O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是 ( )。
| A.配平后的离子方程式为2O3+2I-+4H+=I2+2O2+2H2O |
| B.每生成1 mol I2转移电子2 mol |
| C.O2是还原产物之一 |
| D.该反应能说明O2的氧化性大于I2的 |
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式 。
(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质。A、B分别代表两种含不同化合价的氯元素的物质(每种物质中氮或氯元素的化合价只有一种)。又知物质M中的氮元素化合价要比物质Q中氮元素的化合价低。在一定条件下,它们会发生如下的转化(关系式未配平):
①P+A―→Q+B ②L+O2―→M+H2O ③L+M―→R+H2O ④B+H2O―→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是 ,理由是 。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途,据此推断在同温同压下,若物质R密度比空气的密度小,则R的化学式为 。
(3)某同学写出下面三个含氮的物质相互转换的关系式:
Ⅰ.M+P―→N2O3+H2O
Ⅱ.N2O4+H2O―→P+Q
Ⅲ.M+L―→Q+H2O
其中一定不可能实现的是 ,理由是 。
按要求填空。
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
其中你认为一定不可能实现的是 。
(3)下列三个氧化还原反应中,氧化性最强的物质是 。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还应用上述反应中的 作氧化剂。
已知33As、35Br位于同一周期。某反应中反应物与生成物有以下几种:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式是 。
(3)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将该反应方程式配平后,氧化剂和还原剂的物质的量之比为 ,其中1 mol KBrO3得到电子的物质的量为 mol。
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(2)实验③中的现象为 。
(3)实验①、②中反应的离子方程式分别是 、 。
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:(1)Tl3++2Ag=Tl++2Ag+,(2)Ag++Fe2+=Ag+Fe3+,(3)Fe+2Fe3+=3Fe2+,下列离子氧化性比较顺序正确的是 ( )。
| A.Tl3+>Fe3+>Ag+ | B.Fe3+>Ag+>Tl3+ |
| C.Tl+>Ag+>Fe2+ | D.Tl3+>Ag+>Fe3+ |
已知:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,MnO2+4HCl MnCl2+Cl2↑+2H2O。其中KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(>6 mol·L-1)反应,MnO2需和浓盐酸(>8 mol·L-1)反应。根据以上信息,下列结论中不正确的是 ( )。
MnCl2+Cl2↑+2H2O。其中KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(>6 mol·L-1)反应,MnO2需和浓盐酸(>8 mol·L-1)反应。根据以上信息,下列结论中不正确的是 ( )。
| A.上述反应均属于氧化还原反应 |
| B.生成1 mol Cl2时,三个反应中转移的电子数相等 |
| C.盐酸浓度越大,Cl-的还原性越强 |
| D.氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
根据下列反应,可以判断有关物质的氧化性由强到弱的顺序正确的是( )。
①Cl2+2KI=2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2
④H2S+I2=S↓+2HI
| A.H2S>I2>Fe3+>Cl2 | B.Cl2>Fe3+>I2>S |
| C.Fe3+>Cl2>H2S>I2 | D.Cl2>I2>Fe3+>H2S |
已知下列反应:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O(Ⅰ);5Cl2+I2+6H2O=10HCl+2HIO3(Ⅱ)。下列说法正确的是 ( )。
| A.反应Ⅰ中HCl是氧化剂 |
| B.反应Ⅱ中Cl2发生氧化反应 |
| C.还原性:CoCl2>HCl>I2 |
| D.氧化性:Co2O3>Cl2>HIO3 |
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
| 操 作 |
现 象 |
| 取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH |
pH试纸变红(约为4) |
 |
ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 。
(2)pH≈4的原因是 (用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是 ;证明原因②的实验方案是 。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
| 试管 |
操作 |
现象 |
结论 |
| a |
取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 |
|
Cl2的氧化性强于Fe3+ |
| b |
取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 |
CCl4层没有明显变化 |
|
| c |
|
CCl4层由无色变为橙黄色 |
Cl2的氧化性强于Br2 |