有一混合溶液,其中只含有Fe2+、Cl﹣、Br﹣、I﹣(忽略水的电离),Cl﹣、Br﹣、I﹣的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl﹣和Br﹣的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
| A.7:4 | B.7:3 |
| C.7:2 | D.7:1 |
Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32﹣和Cl2反应的产物之一为SO42﹣.下列说法不正确的是( )
| A.该反应中还原剂是S2O32﹣ |
| B.H2O参与该反应,且作氧化剂 |
| C.根据该反应可判断氧化性:Cl2>SO42﹣ |
| D.上述反应中,每生成l mol SO42﹣,可脱去2mol Cl2 |
下列判断中一定正确的是
| A.若A2+2D-===2A-+D2,则还原性:D->A- |
| B.若R2+和M+的电子层结构相同,则碱性:ROH>MOH |
| C.若X2、Y2都是气态单质,且酸性HX>HY,元素原子得电子能力X>Y |
| D.若M、N是同主族元素,且原子序数:M>N,则元素原子得电子能力:M>N |
已知反应:①2BrO3- + Cl2 =Br2 +2ClO3- ②ClO3- +5Cl-+6H+=3Cl2 +3H2O
下列粒子氧化能力强弱顺序正确的是
| A.ClO3->BrO3->Cl2 | B.BrO3- >Cl2>C1O3- |
| C.Cl2>BrO3->C1O3- | D.BrO3->ClO3->Cl2 |
已知氧化性BrO3->ClO3->Cl2>IO3->I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
(1)可观察到的现象是:
①___________________________________;②___________________________________;
(2)写出有关的离子方程式:
①__________________________________;②___________________________________;
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的离子方程式为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
干法制备:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法错误的是
| A.高铁酸钾与水反应时,水发生氧化反应 |
| B.干法制备中,每生成1 molNa2FeO4,共转移4 mol电子 |
| C.湿法制备中,每生成1 mol Na2FeO4,,共转移3 mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,还能除去等H2S、NH3,并使悬浮杂质沉降 |
今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.HCl | D.FeCl3 |
电解饱和食盐水的反应为2NaCl+2H2O Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。
27. 在上述方程式上标出电子转移的方向和数目。
28. 该反应中被氧化的元素是 。阴极产物之一为H2,阴极上发生的变化为 反应(选填“氧化”、“还原”)。
29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是 (填写编号)。
a.Cl2+2KI→2KCl+I2 b.Cl2 + 2NaOH →NaCl + NaClO + H2O
c.CuCl2 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe 2FeCl3
2FeCl3
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在的较多的阳离子是
| A.Cu2+ | B.Fe3+ | C.Fe2+ | D.H+ |
已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应为:2Fe3+ + Cu = 2Fe2+ + Cu2+),浓H2SO4还可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为
| A.H2SO4(浓) > Cu2+ > Fe3+ > Br2 | B.H2SO4(浓) > Br2 > Fe3+ > Cu2+ |
| C.Br2 > H2SO4(浓) > Cu2+ > Fe3+ | D.Cu2+ > Fe3+ > Br2 > H2SO4(浓) |
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )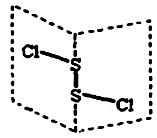
A.S2Cl2与H2O反应的化学方程式可能为: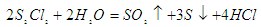 |
| B.S2Cl2为含有极性键和非极性键的极性分子 |
| C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2> S2Cl2 |
D.S2Cl2的电子式是: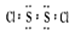 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是( )
① 氧化剂是H3AsO3 ② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol; ④ M为OH-; ⑤ SnCl62-是氧化产物。
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2; ②Fe2O3;③Zn;④KNO3; ⑤HCl; 铜粉可溶解的是 ( )
| A.①②⑤ | B.②④ | C.②③⑤ | D.只有④ |