已知:①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸;③S2﹣易被氯气氧化;④氯化氢比硫化氢稳定;⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应。上述叙述中可说明氯元素比硫元素非金属性强的是( )
| A.①②③ | B.②③④ | C.③④⑤ | D.①③⑤ |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
| A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
| B.CaC2 + 2H2O→CH≡CH↑+ Ca(OH)2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2H2O=4NaOH+O2↑ |
下列变化需加入氧化剂才能实现的是( )
| A.Fe3+→Fe2+ | B.CuO→Cu | C.Cl- →Cl2 | D.H2SO4→BaSO4 |
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
| A.F2、K、HCl | B.Cl2、Al、H2 |
| C.NO2、Na、Br2 | D.O2、SO2、H2O |
X、Z、Y、W 均为四种金属, 根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成的原电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为 ( )
| A.X﹥Z﹥Y﹥W | B.Z﹥W﹥X﹥Y |
| C.Z﹥Y﹥X﹥W | D.Z﹥X﹥Y﹥W |
根据下列三个反应的化学化学方程式,判断下列关系式不正确的是
(1)I2+SO2+2H2O===H2SO4+2HI (2)2FeCl3+2HI===2FeCl2+2HCl+I2
(3)2FeCl2+Cl2===2FeCl3
| A.氧化性:Cl2>Fe3+>I2>H2SO4 | B.还原性:SO2>I->Fe2+>Cl- |
| C.2Fe+3I2===2FeI3 | D.FeI2+Cl2===FeCl2+I2(Cl2不足时) |
制备单质硅时,主要化学反应如下
①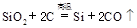 ②
② ③
③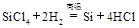 下列对上述三个反应的叙述中,不正确的是( )
下列对上述三个反应的叙述中,不正确的是( )
| A.①③为置换反应 | B.①②③均为氧化还原反应 |
| C.②为化合反应 | D.三个反应的反应物中硅元素均被氧化 |
将32gCu与一定浓度的硝酸混合,二者正好完全反应。产生的NO2、NO混合气体在标准状况下的体积为11.2 L。
(1)分别写出Cu和HNO3反应过程的化学方程式:
,
(2)反应过程中被还原的硝酸的物质的量是 mol
甲乙两种非金属:①甲比乙容易与H2化合;②甲的氢化物比乙的氢化物稳定③
甲的最高价氧化物对应的水化物的酸性比乙的最高价氧化物对应的水化物酸性强;
④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说
明甲比乙的非金属性强的是
| A.只要④ | B.只有⑤ | C.①②③④⑤ | D.①②③ |
下列变化必需加入氧化剂才能实现的是
| A.NH4+→NH3 | B.SO32-→SO42- | C.HNO3→NO | D.CO32-→CO2 |
氯和硫都是重要的非金属元素。下列叙述不能说明氯的非金属性比硫强的是
| A.氯化氢的沸点比硫化氢的沸点高 | B.与氢气反应时,氯气比硫更容易 |
| C.氯气可以从氢硫酸溶液中置换出硫 | D.高氯酸(HClO4)的酸性比H2SO4强 |
甲、乙两种非元素:①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的是( )
| A.只有④ | B.只有⑤ | C.①②③ | D.①②③④⑤ |
根据下列三个反应,判断物质的氧化性由强到弱的顺序正确的是
①2Fe3++2I-=2Fe2++I2
②2Fe2++C12=2Fe3++2C1-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
| A.Fe3+>C12>MnO4- | B.Fe3+>Cl2>I2 |
| C.I2>Cl2>Fe3+ | D.MnO4->Cl2>Fe3+ |