氢硫酸在空气中有如此反应:2H2S+O2==2S↓+2 H2O,下列不正确的是( )
| A.属于置换反应 | B.还原性:H2O> H2S |
| C.氧化性:O2> S | D.酸性:H2S> H2O |
常温下,在溶液中可发生以下反应:
①16H+ +10Z-+2XO4-=== 2X2+ +5Z2 +8H2O,
②2M2++R2 ===2M3++ 2R-,
③2 R-+Z2 ===R2 +2Z-,由此判断下列说法不正确的是( )
| A.常温下反应2M2+ + Z2 ===2M3+ + 2Z-可以自发进行 |
| B.Z元素在反应①中被氧化,在③中被还原 |
| C.氧化性强弱顺序为: XO4- < Z2 < R2 < M3+ |
| D.还原性强弱顺序为: X2+ < Z- < R- < M2+ |
常温下,在下列溶液中发生如下反应: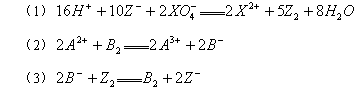
由此判断,下列说法错误的是
A.溶液中不可能发生反应 |
| B.Z2元素在(1)(3)反应中均做还原剂 |
C.氧化性由强到弱顺序是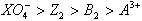 |
| D.X2+是XO4还原产物 |
分析下列反应:5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O,据此作答:
(1)标出该反应中电子的转移方向和数目:
5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O
(2)该反应的氧化剂是 。
(3)该反应的氧化产物与还原产物的质量比是 。
(4)当反应生成0.3 mol Cl2时,则转移的电子的物质的量是 。
从海水中提取溴的过程中涉及到反应:Br2 + SO2 + 2H2O =" 2HBr" + H2SO4,下列说法正确的是
| A.Br2在反应中被氧化 |
| B.SO2在反应中表现还原性 |
| C.H2SO4是还原产物 |
| D.1 mol氧化剂在反应中失去2 mol电子 |
(CN)2、(OCN)2、(SCN)2等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:(OCN)2>Cl2>(CN)2>(SCN)2>I2,写出下列反应的方程式
(1)(OCN)2 + KI
(2)AgCN
(3)(SCN)2 + H2O
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性是顺序为SO2 > I- > Fe2+ > H2O2> Cl-,则下列反应不可能发生的是( )
| A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B.I2+SO2+2H2O=H2SO4+2HI |
| C.2Fe2++I2=2Fe3++2I- |
| D.H2O2+SO2=H2SO4 |
常温下,在溶液中可发生以下反应:①16H++10Z-+2 ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为: <Z2<R2<M3+ <Z2<R2<M3+ |
| B.还原性强弱顺序为:X2+<Z-<R-<M2+ |
| C.Z元素在反应①中被氧化,在③中被还原 |
| D.常温下可发生反应2M2++Z2===2M3++2Z- |
根据以下几个反应:①Cl2+2KI 2KCl+I2 ②2FeCl2+Cl2
2KCl+I2 ②2FeCl2+Cl2 2FeCl3
2FeCl3
③2FeCl3+2KI 2KCl+I2 +2FeCl2 ④I2+SO2+2H2O
2KCl+I2 +2FeCl2 ④I2+SO2+2H2O 2H2SO4+2HI
2H2SO4+2HI
判断氧化性由强到弱的顺序是( )
| A.Cl2>I2>Fe3+>SO2 | B.Cl2>Fe3+>I2>SO2 |
| C.Cl2>Fe3+>SO2>I2 | D.Fe3+>I2>Cl2>SO2 |
在一定条件下,下列微粒的还原性顺序为:Cl-<Br-<Fe2+<I-<SO2,由此判断以下反应在溶液中不能发生的是( )
A.2Fe3++SO2+2H2O 2Fe2++SO42-+4H+ 2Fe2++SO42-+4H+ |
B.2Fe2++Cl2 2Fe3++2Cl- 2Fe3++2Cl- |
C.2Br-+4H++SO42- SO2+Br2+2H2O SO2+Br2+2H2O |
D.I2+SO2+2H2O 4H++SO42-+2I- 4H++SO42-+2I- |
单质X和Y相互反应生成X2+Y2-。现有下列叙述:①X被氧化、②X是氧化剂、③X具有氧化性、④Y2-是还原产物、⑤Y2-具有还原性、⑥X2+具有氧化性、⑦Y的氧化性比X2+的氧化性强,其中正确的是( )
| A.①②③④ | B.①④⑤⑥⑦ | C.②③④ | D.①③④⑤ |
为了比较卤素单质的氧化性强弱可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2)并将Cl2依次通入NaBr溶液和KI淀粉溶液中。如图所示仪器及药品试回答:
(1)若所制取气体从左向右流向时上述仪器接口的连接顺序为F接G、H接______、______接______、A接E。
(2)实验开始后装置5中反应的化学方程式为______________________。
(3)装置3的作用是________________________
反应的离子方程式为______________________________________。
(4)装置1中产生的现象是___________ 反应的离子方程式为____________________。
(5)若溴离子的还原性弱于碘离子的还原性,通过实验,卤素单质的氧化性由强到弱的顺序为__________________。