已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )
| A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
下列说法不正确的是
| A.CCl4是由极性键构成的非极性分子 |
| B.胶体粒子可以透过滤纸但不能透过半透膜 |
| C.氯水中通入SO2气体发生反应,说明Cl2的氧化性强于S |
| D.需要加热才能发生的反应一定是吸热反应 |
在100mL含等物质的量的HI和H2SO3的溶液里通入0.14molCl2,有三分之一的HI变为I2(已知:I2+H2SO3+H2O=4H++SO42—+2I—)。原溶液中HI和H2SO3的浓度都等于
| A.8.0 mol•L-1 | B.0.12 mol•L-1 |
| C.0. 8 mol•L-1 | D.1.2 mol•L-1 |
某溶液中Cl-、Br-、I-三者物质的量之比是2∶3∶4,通入一定量的Cl2,该比值为1∶1∶1,则反应的Cl2和原溶液中I-的物质的量之比是 ( )
| A.1∶2 | B.1∶4 | C.1∶6 | D.1∶8 |
在相同条件下的三个反应: 2A- +B2 =2B- +A2; 2C- +A2 =2A- +C2; 2B- +D2 =2D- +B2,下列判断不正确的是( )
| A.氧化性: B2> A2 | B.还原性: C- > D- |
| C.2A- +D2 =2D- + A2反应可以进行 | D.2C- +B2 =2B- + C2反应不能进行 |
下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是
①2HClO4+Br2(气) = 2HBrO4+Cl2
②2NaBr+Cl2= 2NaCl+Br2
③2KI+Cl2= 2KCl+I2
④2KI+Br2= 2KBr+I2
| A.①②③ | B.①②④ | C.②③④ | D.①②③④ |
铋(Bi)最高化合价为+5价,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色.现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.NaBiO3、KMnO4、H2O2、I2 B.KMnO4、NaBiO3、H2O2、I2
C.I2、H2O2、KMnO4、NaBiO3 D.KMnO4、NaBiO3、I2、H2O2
下列说法正确的是
| A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强 |
| B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为: Fe3+ > Cu2+ > Fe2+ |
| C.已知还原性:B- > C-> D-,反应 2C- + D2 = 2D- +C2和反应 2C- + B2 = 2B- +C2都能发生 |
| D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
已知:Cu+2Fe3+=Cu2++2Fe2+;Zn+2Fe3+=2Fe2++Zn2+。现将等物质的量的CuSO4、FeCl3和Zn于水中充分反应,所得混合物中除了SO42—、Cl—外,还含有( )
| A.Zn2+、Fe3+、Cu | B.Cu2+、Fe3+、Zn |
| C.Zn2+、Cu2+、Fe2+、Fe | D.Zn2+、Fe2+、Cu2+、Cu |
已知I2+SO32—+H2O==2I—+SO42—+2H+。某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-
| A.②③④ | B.①②③ | C.①③ | D.①② |
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.铈(Ce)元素在自然界中主要以单质形式存在 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+ = Ce3++2Fe3+ |
D.四种稳定的核素 、 、 、 、 、 、 ,它们互称为同位素 ,它们互称为同位素 |
氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl﹣<Br﹣<CN﹣<SCN﹣<I﹣.
试写出:
(1)(CN)2与KOH(aq)反应的化学方程式: ;
(2)NaBr和KSCN的混合溶液中加入足量(CN)2反应的离子方程式: .
有一混合溶液,其中只含有Fe2+、Cl﹣、Br﹣、I﹣(忽略水的电离),Cl﹣、Br﹣、I﹣的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl﹣和Br﹣的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
| A.7:4 | B.7:3 | C.7:2 | D.7:1 |
工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为:
(1)4FeO•Cr2O3+8Na2CO3+7O2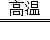 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4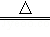 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
| A.反应(1)和(2)均为氧化还原反应 |
| B.反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3 |
| C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D.反应(1)中每生成1molNa2CrO4时电子转移3mol |