下列说法不正确的是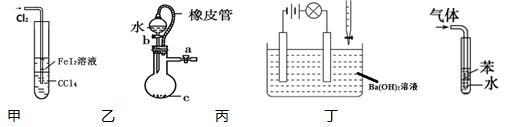
| A.甲装置可以用于比较Fe3+ 、I2 、Cl2的氧化性强弱 |
| B.乙装置中橡皮管的作用是使水能顺利流下 |
| C.丙装置中,若向Ba(OH)2溶液中逐滴加入硫酸溶液直至过量,灯光会由亮变暗至熄灭后又逐渐变亮 |
| D.丁装置用于吸收HCl气体能防倒吸 |
根据离子方程式:(1)2Fe3++2I- 2Fe2++I2,(2)Br2+2Fe2+
2Fe2++I2,(2)Br2+2Fe2+ 2Fe3++2Br-,可判断离子的还原性从强到弱的顺序是
2Fe3++2Br-,可判断离子的还原性从强到弱的顺序是
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- |
| C.Br-、I-、Fe2+ | D.Fe2+、I-、Br- |
下列对有关化学反应过程或实验现象的解释中,正确的是
| A.Fe(OH)3胶体中加入Na2SO4溶液后有红褐色沉淀生成,说明胶体是很不稳定的分散系 |
| B.H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强 |
| C.向淀粉碘化钾溶液中加入双氧水,溶液变为蓝色,说明过氧化氢的氧化性强于I2 |
| D.向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2溶液有酸性 |
根据以下几个反应:
①Cl2+2KI 2KCl+I2 ②2FeCl2+Cl2
2KCl+I2 ②2FeCl2+Cl2 2FeCl3
2FeCl3
③2FeCl3+2KI 2FeCl2+2KCl+I2 ④I2+SO2+2H2O
2FeCl2+2KCl+I2 ④I2+SO2+2H2O H2SO4+2HI
H2SO4+2HI
判断还原性由强到弱的顺序是
| A.I->Fe2+>SO2 >Cl- | B.SO2>Fe2+>I-> Cl- |
| C.SO2>I ->Fe2+> Cl- | D.Fe2+>I->Cl->SO2 |
已知氧化性R2>Z2>X2>Y2 ,下列反应能发生的是
| A.2X-+Z2= X2+2Z- | B.2R-+Z2= R2+2Z- |
| C.2R-+Y2= R2+2Y- | D.2Z -+Y2=Z2+2Y- |
已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,判断下列氧化还原反应能发生的是
| A.2W-+Z2=2Z-+W2 | B.2 W-+ Y 2=2 Y-+ W 2 |
| C.2X-+Z2=2Z-+X2 | D.2Z-+X2=2X-+Z2 |
已知:①2FeCl3+2KI=2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3。下列粒子的氧化性从强到弱的顺序正确的是
| A.Cl2>Fe3+>I2 | B.I2>Cl2>Fe3+ |
| C.Fe3+>Cl2>I2 | D.Cl2>I2>Fe3+ |
有A、B、C、D四种物质,已知它们能发生下列变化:
①A2++B=B2++A ②A2++C=C2++A
③B2++C=C2++B ④C2++D=D2++C
由此可推知,各物质的氧化性、还原性强弱顺序正确的是
①氧化性:A2+>B2+>C2+>D2+
②氧化性:D2+>C2+>B2+>A2+
③还原性:A>B>C>D
④还原性:D>C>B>A
A.①③ B.①④ C.②④ D.②③
根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O=H2SO4+2HI
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.Fe2+>I->H2SO3>NO | B.I->Fe2+>H2SO3>NO |
| C.H2SO3>I->Fe2+>NO | D.NO>Fe2+>H2SO3>I- |
已知①向KI溶液中通入过量Cl2会有KIO3生成;②向酸化的KI与KIO3混合液中滴加淀粉溶液会变蓝色。下列有关说法正确的是
A.Iˉ只有还原性,IO 只有氧化性 只有氧化性 |
B.由①②可知氧化性的强弱顺序为Cl2>I2>IO |
C.①中发生反应的离子方程式为:3Cl2+Iˉ+3OHˉ=IO +6Clˉ+3H+ +6Clˉ+3H+ |
| D.反应②中若有5mol电子转移,则生成3mol单质I2 |
常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br-,
②2Br-+Cl2=Br2+2Cl-,③2Fe3++2I-=2Fe2++I2。
由此判断下列说法正确的是
| A.铁元素在反应①和③中均被氧化 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序:Cl2>Br2>I2> Fe3+ |
| D.还原性强弱顺序:I-> Br->Fe2+>Cl- |
根据下列反应判断有关的物质氧化性由强到弱的顺序是
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3.
| A.H2SO3>I﹣>Fe2+>NO | B.HNO3>Fe3+>I2>H2SO4 |
| C.HNO3>Fe3+>H2SO3>I2 | D.NO->Fe2+>H2SO3>I﹣ |
根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是
(1)Cl2+2KI=2KCl+I2;
(2)2FeCl2+Cl2=2FeCl3;
(3)2FeCl3+2HI=2FeCl2+2HCl+I2;
(4)H2S+I2=S+2HI;
| A.S>I2>Fe3+>Cl2 | B.Cl2>Fe3+>I2>S |
| C.Fe3+>Cl2>S>I2 | D.Cl2>I2>Fe3+>S |
已知I﹣、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Fe2+<H2O2<I﹣<SO2,则下列反应不能发生的是
| A.2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+ |
| B.H2O2+H2SO4═SO2+O2+2H2O |
| C.I2+SO2+2H2O═H2SO4+2HI |
| D.2Fe3++H2O2═2Fe2++O2↑+2H+ |
已知2Fe3++2I-=2Fe2++I2、Br2+2Fe2+=2Fe3++2Br-。现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①按Br2、Fe3+、I2的顺序氧化性逐渐减弱
②原溶液中Br-一定被氧化
③通入氯气后原溶液中的Fe2+一定被氧化
④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
| A.①②③④ | B.①③④⑤ | C.②④⑤ | D.①②③④⑤ |