现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A 、 B 、 C 、乙
(2)写出下列反应化学方程式:
反应①
反应③
(3)写出下列反应离子方程式:
反应④
反应⑥
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、D所含物质的化学式
固体B ;沉淀D 。
(3)写出①、②反应的离子方程式:
① ;② ;
(4)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。
根据下图转化关系以及实验现象填写空白。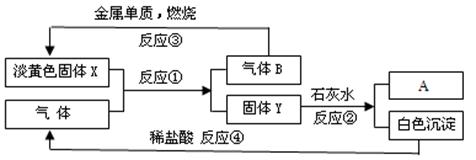
(1)固体X是_______,产物A是_______(填写化学式)。
(2)反应①的化学方程式是 ____________________。
(3)反应④的离子方程式是 _____________________________。
暗紫色化合物A可作为电极材料的新型超铁电磁,因具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)3.96 g化合物A中含有Fe元素的物质的量为 mol,含有钾元素的物质的量为 mol。化合物A的化学式为 ;
(2)化合物A与H2O反应的离子方程式为 。
(3)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案 。
A溶液和B溶液按如下程序进行实验,根据下述现象判断:
(1)A溶液中的溶质的化学式 ,B溶液中的溶质的化学式 。
(2)完成下列转化的化学方程式,并用“单线桥法”标明电子转移的方向和数目:
D+H2=H+P:
(3)写出下列反应的离子方程式:
A+B:
F+盐酸:
(4)溶液B中阴离子的检验方法是
生铁中一般含有化合物B,B只有两种元素组成,它的含量、形状、分布对生铁性能影响很大,使生铁硬而脆,不宜进行机械加工。已知:(1)E、F、H、I、P常温下为气体,H、I、P为单质,E是一种红棕色气体。(2)反应①②均为制备理想的绿色水处理剂Na2FeO4的方法,其中反应①在生成Na2FeO4同时还生成NaNO2和H2O。各物质之闻的转化关系如下图所示f图中部分生成物没有列出)。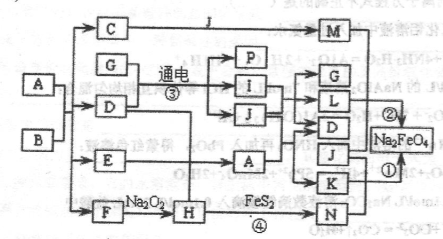
请填写以下空白:
(1)用电子式表示F的形成过程_________________________________________
(2)按要求完成下列反应:__________________________________________
反应③的离子方程式为________________________________________
反应①的化学方程式为________________________________________
(3)反应②中氧化剂与还原剂的物质的量比为__________________________________
反应④中的氧化产物的化学式为_______________________________________
(4)实验室中检验C溶液中金属阳离子的常用方法是________________________
(5)如果A与B反应时生成E与F的物质的量比为13:1,则化合物B的化学式为__________