下列叙述错误的是
| A.碱金属元素原子最外层都只有1个电子 |
| B.依Li、Na、K、Rb,单质熔沸点升高,密度增大 |
| C.单质氧化性:F2>Cl2>Br2>I2 |
| D.氢化物稳定性:HF>HCl>HBr>HI |
根据下列各反应现象所归纳的元素性质不正确的是
| A.将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出。不能说明钠的金属性比铜弱 |
| B.用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝。说明氯元素的非金属性比碘元素强 |
| C.把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出。说明Cl的非金属性比S强 |
| D.将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol。说明这三种金属的活泼性为:Al>Mg>Na |
下列说法正确的是
| A.Li是最活泼金属,F是最活泼非金属 |
| B.Mg(OH)2碱性比Ca(OH)2强 |
| C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 |
| D.X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
某元素B 的核电荷数为Z,已知Bn-和Am+的核外具有相同的电子数,则A 元素的原子序数用Z、n、m 来表示,应为
| A.Z+m+n | B.Z-n+m | C.Z-n-m | D.Z+n-m |
13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wu thrich等人为此获得2002年诺贝尔化学奖.下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数 B.13C与12C属于同种核素
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E和F周周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素F在周期表中的位置_______________________;
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)____________;
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有_________;检验该化合物中的阳离子的方法是____________________(用离子方程式表示及文字描述表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:_______________________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________________。
X、Y、Z、W是短周期的四种元素,有关他们的信息如下表所示。
| 元素 |
部分结构知识 |
部分性质 |
| X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
| Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化合价代数和等于6 |
| W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)Z元素在周期表中的位置是__________;Y的一种氧化物能导致温室效应,该氧化物的电子式为____;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为_______。
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是_______。
(3)实验室制取Z单质的化学方程式为_____________________________。
(4)实验室制取X的氢化物的化学方程式为_____________________________;工业上用此氢化物制取X的最高价含氧酸的第一步反应方程式为__________________________________。
(5)实验室用X的氢化物的水溶液制取W的氢氧化物的离子方程式为_________________。
月球表面土壤里有一种非常有用的资源——He,它是可控核聚变的原料,关于He的叙述正确的是
| A.3He和4He是同种原子 |
| B.3He和4He互为同位素 |
| C.核聚变时,原子核发生了变化,发生了化学反应 |
| D.在3He中存在:质子数=中子数=核外电子数 |
氧硫化碳(COS)可替代磷化氢而被用作蒸剂。
(1)组成氧硫化碳和磷化氢的各元素中,原子半径最大的元素是___________________(填元素符号)。
(2)下列事实可用于比较C与P两种元素非金属性相对强弱的是____________(填字母)。
a.最高正化合价:P>C
b.同温同浓度的两溶液的酸性:H3PO4>H2CO3
c.沸点:PH3>CH4
(3)氧硫化碳水解及部分应用流程如下(部分产物已略去):
①已知:常温下,反应Ⅱ中每吸收1.7g H2S气体,反应放出热量4.76kJ,则该反应的热化学方程式为____________________。
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为___________。
随着原子序数的递增,八种短周期元素原子半径的相对大小和最高正价或最低负价如图所示。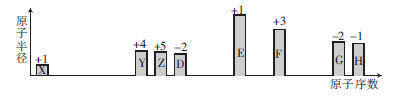
(1)元素Z位于元素周期表的第__________周期___________族,X与Z可形成18电子的化合物,该化合物的电子式为_______________。
(2)非金属性:Y___________(填“>”“<”或“=”)D。
(3)单质F与EDX溶液反应的化学化学方程式为____________________。
(4)G和H可形成一种化合物,其相对分子质量在90~110之间。且G的质量分数约为31.1%,该化合物的化学式为_________。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是
| A.简单离子半径:W>X>Z |
| B.最简单气态氢化物的稳定性:Y<Z |
| C.化合物XZW中既含离子键又含共价键 |
| D.Y的氧化物能与X的最高价氧化物对应的水化物反应 |
中国计量科学研究所研制的NIM5铯原子喷泉钟,2000万年不差一秒,日前成为国际计量局认可的基准钟之一,参与国际标准时间修正。关于Cs元素,下列说法错误的是
| A.137Cs和133Cs互为同位素 |
| B.单质Cs与水反应非常缓慢 |
| C.137Cs比133Cs比多4个中子 |
| D.137Cs最外层只有1个电子 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
R |
W |
| 原子半径/pm |
160 |
143 |
89 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+2 |
+5、-3 |
-2 |
下列叙述正确的是
A.X、Z元素的金属性:X < Z
B.一定条件下,R单质与常见的W单质能直接生成RW2
C.气态氢化物的稳定性:R > W
D.Y的最高价氧化物既能溶于H2SO4又能溶于NaOH