【化学—选修3:物质结构】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子; B元素是地壳中含量最多的金属元素;C原子核外的M层中有两对成对电子;D是使用最广泛的合金的主要成分。E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E+离子的最外层电子排布式_____________ ,A、B、C的第一电离能最小的是____________ 。
(2)A的最高价含氧酸分子中心原子是____________________杂化。
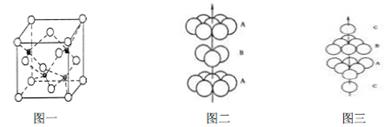
(3)A、B形成某种化合物的晶胞结构如下图一所示(“O”表示B原子),则其化学式为________ ,一个A原子周围距离最近且等距的A原子有_____________个。B原子的堆积方式与下图中的_______相同。(填“图二”或“图三”)
(4)1183 K 以下D 晶体的晶胞为钾型,而1183 K 以上则转变为铜型,在两种晶胞中最邻近的D 原子间距离相同,则两种晶体中原子的空间利用率之比为____(可用根号表示)。
(5)开发新型储氢材料是氢能利用的重要研究方向。分子X 可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X 一定不是______(填标号)。
A. H2O B. CH4 C. HF D. CO(NH2)2
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的是
| 元素代号 |
A |
B |
C |
D |
E |
F |
G |
| 原子半径/nm |
0.182 |
0.160 |
0.089 |
0.143 |
0.102 |
0.099 |
0.071 |
| 主要化合价 |
+1 |
+2 |
+2 |
+3 |
+6.-2 |
-1 |
-1 |
A.气态氢化物的稳定性HG>HF>H2E
B.B2+、D3+、E2-、G-四种离子的核外电子排布相同
C.A、E元素与氧元素可以形成三种常见的含氧酸盐
D.C元素的原子最外层电子数等于电子层数
短周期元素X、Y、Z、W、U原子序数依次递增。X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13。Y元素的单质在X的某种氧化物中可燃。下列说法正确的是
| A.X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X |
| B.Y、Z元素的单质作电极,在NaOH溶液中构成原电池,Z电极上产生大量气泡 |
| C.Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
| D.室温下,0.05 mol/L U的气态氢化物的水溶液的pH>1 |
【化学一选修3:物质结构与性质】
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是____。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_ _>____;比较g、h的最高价氧化物对应的水化物的酸性强弱是:__ _>_ _。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:①R离子浓度由大到小的顺序是:______ _。②写出m点反应的离子方程_ 。③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )

| A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 |
| B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 |
| C.YX2晶体熔化、液态WX3气化均需克服分子间作用力 |
| D.根据元素周期律可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
下列说法正确的是
| A.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓ |
B. 与 与 互为同位素 互为同位素 |
| C.H3O+和NH4+具有的电子数相同 |
| D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知YW的原子序数之和是Z的3倍,下列说法正确的是( )
| |
Y |
Z |
|
| X |
|
|
W |
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
下列有关性质的比较,不能用元素周期律解释的是( )
| A.热稳定性:Na2CO3>NaHCO3 | B.非金属性:Cl>Br\ |
| C.碱性:NaOH>Mg(OH)2 | D.酸性:H2SO4>H3PO4 |
下列叙述不正确的是( )
① 熔点:金刚石>晶体硅>单质硫
② 气态氢化物的稳定性:H2O>HF>H2S
③ 同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
④ 因为常温下白磷可自燃,而氮气需要在放电时才与氧气反应,所以非金属性:P>N
⑤ 碱性氧化物一定是金属氧化物
| A.①②③ | B.②③④ | C.②④⑤ | D.①③⑤ |
[化学—物质结构与性质]
A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)A、B的元素符号依次为_____________、_______________;
(2)AC2与BC2分子的立体结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是___________________________________________;
(3)D的核外电子排布式为________________________,在形成化合物时它的最高化合价为__________。
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应.下列说法错误的是( )
| A.元素丙的单质可用于冶炼金属 |
| B.甲与丁形成的分子中有非极性分子 |
| C.简单离子半径:丁>乙>丙 |
| D.甲与乙形成的化合物均有氧化性 |
一般情况下,前者无法决定后者的是( )
| A.原子核外电子排布﹣﹣元素在周期表中的位置 |
| B.弱电解质的相对强弱﹣﹣电离常数的大小 |
| C.分子间作用力的大小﹣﹣分子稳定性的高低 |
| D.物质内部储存的能量﹣﹣化学反应的热效应 |
如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

| A.y轴表示的可能是基态的原子失去一个电子所需要的最小能量; |
| B.y轴表示的可能是原子在化合物中吸引电子的能力标度; |
| C.y轴表示的可能是原子半径; |
| D.y轴表示的可能是形成基态离子转移的电子数 |
X、Y、Z、W、Q都是短周期主族元素,其中X是短周期原子半径最大的元素,X与Y处于同一周期,Y与Z同主族且能形成两种常见的化合物,W能形成两种简单的离子,Q原子的电子总数等于其电子层数的3倍。下列说法正确的是
| A.元素Q是短周期非金属性最强的元素 |
| B.Y、Z形成的化合物中只有一种属于酸性氧化物 |
| C.Y、Z、Q分别与W形成的化合物中,Z形成的化合物的沸点最高 |
| D.X分别与Y、Z、W形成的化合物中可能既含离子键又含共价键 |
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 元素性质或原子结构
A 周期表中原子半径最小的元素
B 原子核外有三种不同的能级且各个能级所填充的电子数相同
C 最外层p轨道半充满
D 位于短周期,其原子的核外成对电子数是未成对电子数的3倍
E 位于ds区且原子的最外层电子数与A的相同
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为______________。
(2)E的二价离子的电子排布式为______________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为_______________;1 mol A2B2D4分子中含有σ键数目为____________。
(4)与化合物BD互为等电子体的阴离子化学式为________________(任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是__________________。
(6)BD2在高温高压下所形成晶体的晶胞如图所示。一个该晶胞中含______________个D原子。
