工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| 溶解度/g |
41.8 |
54.1 |
70.4 |
74.8 |
67.2 |
60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
(14分,每空2分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4晶体的制备路线如下:
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
回答下列间题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 。
(2)操作I是 。
(3) SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因: 。
(4)加入Sn粉的作用有两个:①调节溶液pH;② 化。
(5)反应I得到的沉淀是SnO,得到该沉淀的离子反应方程式为: 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是: 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl=SnCl2+H2↑;
②加入过量的FeCl3溶液;
③用已知浓度的K2 Cr2O7溶液滴定②中生成的Fe2+,发生的反应为:
6FeCl2+ K2 Cr2O7+14HCl=6FeCl3 +2KCl+2CrCl3+7H2O。
取1.226 g锡粉,经上述各步反应后,共用去0.100 mol/L K2 Cr2O7洛液32.00 mL。锡粉中锡的质量分数是 。
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下: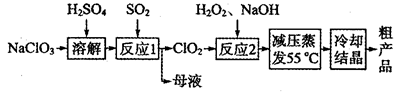
(1)提高“反应l”反应速率的措施有________________________(写出一条即可)。
(2)“反应2”的氧化剂是_____________,该反应的化学方程式为__________________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从“母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经______________(填操作名称)即可获得粗产品。
是锂离子电池中广泛应用的电解质。某工厂用
、
为原料,低温反应制备
,其流程如下:

已知:的沸点是-85.0 ℃,
的沸点是19.5 ℃。
(1)第①步反应中无水的作用是、。反应设备不能用玻璃材质的原因是(用化学方程式表示)。无水
有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中极易水解,其产物为两种酸,写出
水解的化学方程式:。
(3)第④步分离采用的方法是;第⑤步分离尾气中HF、HCl采用的方法是。
(4)产品中通常混有少量
。取样品
。测得
的物质的量为
,则该样品中
的物质的量为
(用含有
、
的代数式表示)。
利用和钴氧化物可制备锂离子电池正极材料。
可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为和
溶液。
极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中
向电极迁移(填"A"或"B")。

(2)利用钴渣[含、
等]制备钴氧化物的工艺流程如下:

溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧
生成钴氧化物和
,测得充分煅烧后固体质量为
,
的体积为
(标准状况),则钴氧化物的化学式为。
氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
(3)析出CuCl晶体时的最佳pH在 左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
(5)从滤液A中可回收的主要物质是 (写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为
焦亚硫酸钠( )常用作食品漂白剂,其制备工艺流程如下:
)常用作食品漂白剂,其制备工艺流程如下:
已知:反应Ⅱ包含 等多步反应。
等多步反应。
(1)反应Ⅰ的化学方程式为____________,反应Ⅰ进行时应先通入__________气体。
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是__________。在上述工艺流程中可循环使用的物质是_____________。
(3)反应Ⅱ中需控制参加反应的气体与固体的物质的量之比接近____________,若气体量不足,则会导致_______________。
(4) 与稀硫酸反应放出
与稀硫酸反应放出 ,其离子方程式为___________。
,其离子方程式为___________。
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示:
| T/℃ |
20 |
40 |
60 |
80 |
 (Li2CO3)/g (Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
 (Li2SO4)/g (Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
③从滤渣1中提取出Si的部分流程如下图所示:
根据以上信息,请回答下列问题:
(1)括号内应提供的相应条件和物质 、 。
(2)方框中所得物质的化学式 。
(3)使用浓硫酸并加热到250℃~300℃的目的是 。
(4)②处加Na2CO3溶液所发生反应的离子方程式 、 。
(5)滤渣2的主要成分有 。
(6)如何检验Li2CO3是否洗涤干净? 。
二氧化锗一般由四氯化锗水解制得,被广泛用于制作高纯金属锗、化工催化剂及电子器件等。现以含锗烟尘(主要含GeO2、SiO2和ZnO)为原料可制备GeO2,其工艺流程图如下:

已知;GeO2是两性氧化物;GeCl4易水解,沸点为86.6 ℃。
(1)第①步滤渣的主要成分有_ (填化学式),第④步操作所需的玻璃仪器为锥形瓶、牛角管、温度计、酒精灯、冷凝管和_ 。
(2)第③步萃取时,锗的萃取率与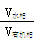 (水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的
(水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的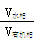 的值为_ 。
的值为_ 。

(3)第④步加入盐酸的作用_ (答两点即可)。
(4)第⑤步反应的化学方程式是_ 。
(5)检验GeO2·nH2O是否洗涤干净的操作是_
选做【化学——化学与技术】工业上提炼TiO2的工艺流程如下: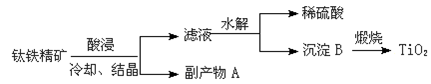
(1)写出硫酸溶解钛铁精矿(FeTiO3)生成TiO2+的离子方程式 。
(2)副产物A的主要成分为 。
(3)滤液水解时往往需加大量水稀释同时加热,其目的是 。
(4)上述工艺流程中体现绿色化学理念的是 。
(5)工业上将TiO2和碳粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式: 、 。
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图:回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠,甲酸钠加热脱氢的化学反应方程式分别为:____、____ 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是____ ;过滤操作②的滤液是 和 ,滤渣是____ 。
(3)工艺过程中③和④的目的是____ 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是___ 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMn04溶液滴定,至浅粉红色不消褪,消耗KMn04溶液15.00 mL,反应的离子方程式为____ ;
列式计算该成品的纯度 。
(16分) 以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。

(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为 。
(2)写出木屑水解反应的化学方程式: 。配平浸出步骤反应方程式C6H12O6 + MnO2 + H2SO4→ MnSO4 + CO2 + H2O
(3)若取消除酸操作步骤,将会产生 气体(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式 ;
(5)取一定量的阳极泥进行实验分析,得到如下图像。硫酸的最合适用量为 mL,若再增加硫酸的用量,将会导致 (填化学式)的消耗量增大。
(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于 L。(假设阳极泥中的其它成分不参与反应)
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: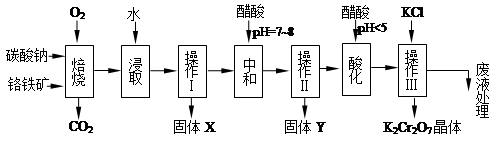
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
根据题意回答下列问题:
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、_______、干燥。
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl →K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
| 物质 |
溶解度/(g/100g水) |
||
| 0°C |
40°C |
80°C |
|
| KCl |
28 |
40.1 |
51.3 |
| NaCl |
35.7 |
36.4 |
38 |
| K2Cr2O7 |
4.7 |
26.3 |
73 |
| Na2Cr2O7 |
163 |
215 |
376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、……灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_______(用含m、n的代数式表示)。
(6)六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下: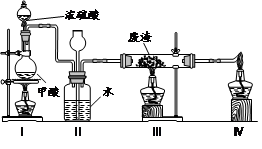
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是_________________________。
辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:

① 步骤I中用稀硫酸浸取矿石,为提高浸取率可采取的措施有 (任写一种)。
② 步骤Ⅱ中调节浸出液pH=3.5的作用是 ;
③ 步骤Ⅰ中发生如下3个反应,已知反应Ⅰ中生成的硫酸铁起催化作用。请写出反应Ⅲ的化学方程式。
Ⅰ.Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
Ⅱ.Cu2S+ Fe2(SO4)3 = CuSO4+CuS+2FeSO4
Ⅲ. 。
④步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 。
[化学——选修2:化学与技术](15分)最近的研究发现,复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,因而受到许多发达国家的青睐。MnFe2O4的制备流程如下: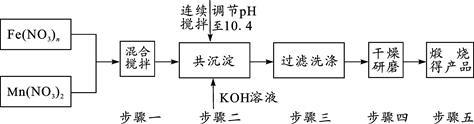
(1)原料Fe(NO3)n中n=____,投入原料Fe(NO3)n和Mn(NO3)2的质量之比应为______。
(2)步骤二中“连续搅拌”的目的是___________________________________________;
步骤三中洗涤干净的标准_____________________________________________。
(3)利用MnFe2O4热化学循环制氢的反应可表示为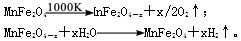
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.6,则MnFe2O4-x中Fe2+占全部铁元素的百分率为_______。
②该热化学循环新氢法的优点有____________________________(答两点即可)。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是_____________。