锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4)含Al2O3、SiO2、Fe2O3等杂质,碱熔法生产锆的流程如下:

已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Zr(OH)4 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
| 开始沉淀时pH |
1.2 |
2.7 |
3.4 |
6.3 |
| 完全沉淀时pH |
2.4 |
3.2 |
5.2 |
9.7 |
(1)完成高温熔融时的主要反应方程式:ZrSiO4 + 4NaOH = Na2ZrO3 + +
(2)为了提高浸出率可采取的方法有 、 (列举两种)
(3)生成滤渣2的成分 (用化学式表示)
(4)用氨水将滤液2的pH调至 ≤pH< ,目的是 。
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入 气流同时蒸发结晶,可回收得到铁的氯化物FeCl3晶体。
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:


已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解。
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕
(2)沉锰工序中,298K、c(Mn2+)为1.05 mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、 。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol·L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应。
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4- + 5C2O42- + 16H+ ="=" 2Mn2+ + 10CO2↑+ 8H2O
MnO2 + C2O42- + 4H+ ="=" Mn2+ + 2CO2↑+ 2H2O
求该软锰矿中二氧化锰的质量分数 (写出计算过程)。
镍是有机合成的重要催化剂,某化工厂有含镍催化剂废品(主要成分是镍、杂质是铁、铝单质及其化合物,还有少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 |
开始沉淀 |
完全沉淀 |
| Al(OH)3 |
3.8 |
5.2 |
| Fe(OH)3 |
2.7 |
3.2 |
| Fe(OH)2 |
7.6 |
9.7 |
| Ni(OH)2 |
7.1 |
9.2 |
回答下列问题:
(1)溶液①中含金属元素的离子是_________________。
(2)用离子方程式表示加入双氧水的目的___________;双氧水可以用下列物质替代的是_______。
A.氧气 B.漂白液 C.氯气 D.硝酸
(3)操作a和c需要共同的玻璃仪器是_____________;操作C的名称是______________。
(4)如果加入双氧水量不足或“保温时间较短”,则所制备的产品可能含有的杂质为_____________;请选择合适的试剂,设计实验证明产品中是否含“杂质” ______________。
(5)含镍金属氢化物MH-Ni燃料电池是一种绝色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M  MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
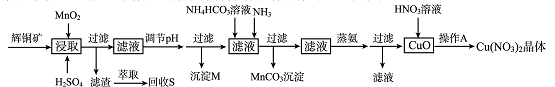
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol.L-1计算)。
| 离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Mn2+ |
8.3 |
9.8 |
| Cu2+ |
4.4 |
6.4 |
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式 。
(2)调节pH的目的是 ,pH的调节范围为_____________。
(3)生成MnCO3沉淀的离子方程式为 。
(4)操作A为 。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2 (g) =2Cu2O(s)+2SO2(g) △H="-" 768.2 kJ.mol-l
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2 (g) △H="+116.0" kJ.mol-l
则由Cu2S与O2加热反应生成Cu的热化学方程式为_____________。
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(NO3)2。假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.0 kg这样的辉铜矿最多能制备 kg无水Cu(NO3)2。
铁及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为 。
(2)生铁中含有一种铁碳化合物X(Fe3C),X在足量的空气中高温煅烧,生成有磁性氧化物Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式 。
(3)某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2·H2O的工艺流程如下:
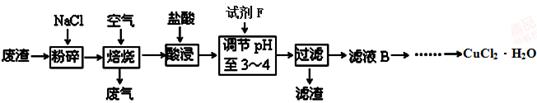
已知:Fe(OH)2、Fe(OH)3、Cu(OH)2沉淀完全时的pH值分别为9.7、3.3、6.4。
试回答下列问题:
①试剂F应选用 (填编号)。
A.Cl2 B.NaClO C.HNO3 D.浓硫酸
理由是 。
②为了获得晶体,对滤液B进行的操作是蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线(如图),“趁热过滤”得到的固体是 。

(除标注外,每空2分,共8分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是__ __。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是__ _。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:
____。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值。涉及反应如下(均未配平):
NiOOH+Fe2++H+——Ni2++Fe3++H2O
Fe2++MnO +H+——Fe3++Mn2++H2O
+H+——Fe3++Mn2++H2O
则x=____;y=__。
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下: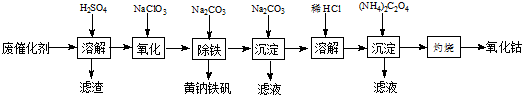
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是_________________,所得滤渣的主要成分是_________(写化学式)。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式_________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]•3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是______________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式______________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是______________。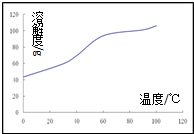
(5)溶解:CoCl2的溶解度曲线如图所示向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是______________。
(6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式_________。
工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:

(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为_____________。能提高烧渣浸取速率的措施有________________(填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是______________(填字母)。

A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有_________________。
(3)滤渣Ⅱ主要成分的化学式为_______________;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是_____________、_____________过滤、洗涤、干燥。
草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 完全沉淀的pH |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
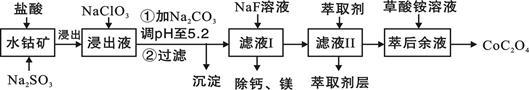
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)= 。
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹。
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式 。
(2)一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:

①净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
②在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度 ;体系中要通入适量的氢气是为了 。
③X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(3)工业上可以通过如下图所示的流程制取纯硅:

①整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应,写出该反应的化学方程式 。
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%。则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为 。
(2)现代冶炼金属锰的一种工艺流程如下图所示:
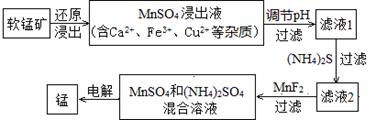
下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
| 物质 |
Fe(OH)3 |
Cu(OH)2 |
Ca(OH)2 |
Mn(OH)2 |
CuS |
CaS |
MnS |
MnCO3 |
| pKsp |
37.4 |
19.32 |
5.26 |
12.7 |
35.2 |
5.86 |
12.6 |
10.7 |
软锰矿还原浸出的反应为:12MnO2 + C6H12O6 + 12H2SO4=12MnSO4 + CO2↑+18H2O
①该反应中,还原剂为__________。写出一种能提高还原浸出速率的措施: 。
②滤液1的pH (填“>”、“<”或“=”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,,该反应的离子方程式为_____________________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s) + 2OH-(aq) Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
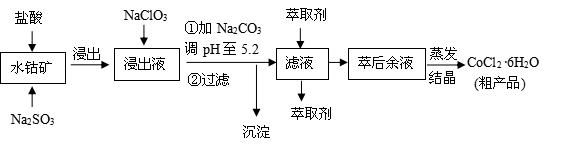
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为 ,加入萃取剂的目的是 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3 溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
Ni元素化合物在生活中有非常重要的应用。纳米NiO可以制备超级电容器,NiOOH是制作二次电池的重要材料。现以NiSO4为原料生产纳米NiO和NiOOH流程如下:

(1)制备NiOOH过程中,NiSO4溶液配制方法__________________;过滤、洗涤后,得到Ni(OH)2固体,如何证明Ni(OH)2已经完全洗净______________;NaClO氧化Ni(OH)2的离子方程式为_________________。
(2) 已知Ksp[Ni(OH)2] = 2×10-15。室温下,欲加入一定量 NaOH固体使1L 含有0.001 mol·L-1的NiSO4和0.0001 mol·L-1的H2SO4溶液中残留c(Ni2+)≤2×10-7 mol·L-1,并恢复至室温,所加入的NaOH的固体质量至少为________g。
(3)NH3·H2O的浓度对纳米NiO的产率产生很大影响。右图为NiSO4的物质的量一定时,不同的反应物配比对纳米氧化镍收率的影响。请解释反应物NH4HCO3 和NiSO4的物质的量比在2.5至4.0时,收率升高的原因__________________。
(4)制备纳米 NiO 时,加入一些可溶于水的有机物(如:吐温—80)能制得更优质的纳米材料,原因是__________________。
(5)沉降体积是超细粉体的一个重要参数,若颗粒在液相中分散性好,则沉降体积较小;若颗粒分散性较差,则易引起絮凝沉降体积较大。右图是吐温—80 的加入量与前体在液体石蜡中沉降体积的关系曲线。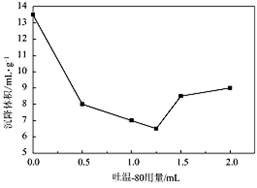
通过右图分析,吐温—80的最佳加入量为__________mL。
(6)NiOOH是制备镍镉电池的原料,某镍镉电池的总反应为
Cd+2NiOOH + 2H2O Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2
该电池放电时正极电极反应式为______________________________。
碱式碳酸铜[CuCO3·Cu(OH)2]是一种用途广泛的化工原料,可用于作有机催化剂、颜料制造、原油贮存时脱碱等。用废杂铜(主要成分为Cu,还含有少量杂质Fe)制取碱式碳酸铜的工艺流程如图所示。
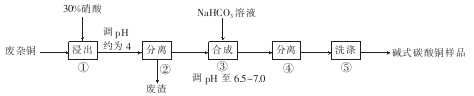
(1)步骤①浸出时,硝酸浓度不易过大,其原因是____。
(2)步骤②分离前需将溶液pH调节在4左右,其目的是 ,所得废渣的主要成分为____________。
(3)步骤③合成时,采用将NaHCO3溶液迅速投入Cu(NO3)2溶液中,其主要原因是 ;合成时发生反应的化学方程式为____________。
(4)本实验中两次用到固液分离,本实验中最适合固液分离的设备是____________。
(5)步骤⑤洗涤主要除去的杂质离子是 。
(6)准确称取所得产品m g,放入碘量瓶中,加入2 g KI及5 ml3 mol/L稀硫酸(两试剂均过量)摇匀并静置10 min(2Cu2++4I-=2CuI↓+I2),再加入2 mL淀粉溶液,用c mol/L的Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),到滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜元素的质量分数为________。
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:
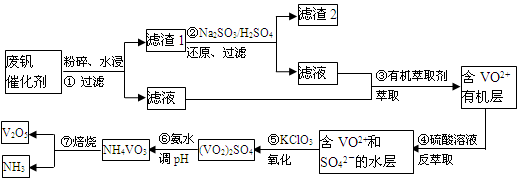
已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。
(2) VO2++H2C2O4+H+ → VO2+ + CO2↑+ H2O
回答下列问题:
(1)步骤②的目的是 。
(2)步骤③的变化过程可简化为(HA表示有机萃取剂):
VOSO4 (水层)+ 2HA(有机层) VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
(3)若ClO3-将被还原为Cl-,请写出骤⑤中发生反应的离子方程式为 。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.00mL,由此可知(VO2)2SO4溶液钒元素的含量为 g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为 。