在镁与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,则10s内生成氢气的平均反应速率是
反应4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是( )
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是( )
| A.v (O2) = 0.01mol·(L·s) –1 | B.v (NO) =" 0.008mol·(L·s)" –1 |
| C.v (H2O) =" 0.003mol·(L·s)" –1 | D.v (NH3) =" 0.02mol·(L·s)" –1 |
反应4A(g)+5B(g) 4C(g)+6D(g)在5L的密闭容器中进行反应,30 min后,C的物质的量增加了0.30 mol。下列叙述正确的是
4C(g)+6D(g)在5L的密闭容器中进行反应,30 min后,C的物质的量增加了0.30 mol。下列叙述正确的是
A.30 min 中A的平均反应速率是0.010 mol•L-1•s-1
B.容器中含D的物质的量为0.45 mol
C.容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D.容器中A的物质的量一定增加0.30 mol
在2A+B  3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=0.6 mol·L-1·min-1
CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
| A.CO全部转化为乙醇 |
| B.正反应和逆反应的化学反应速率均为零 |
| C.CO和H2以1∶2的物质的量之比反应生成乙醇 |
| D.反应体系中乙醇的物质的量浓度不再变化 |
保持相同的温度,可逆反应2A(g(+B(g) 2C(g)在1×105Pa和1×106Pa条件下分别达到平衡时的逆反应速率,后者与前者相比较 ( )
2C(g)在1×105Pa和1×106Pa条件下分别达到平衡时的逆反应速率,后者与前者相比较 ( )
| A.大于 | B.小于 | C.等于 | D.无法确定 |
高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )
Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )
| A.增加铁的量 |
| B.将容器的体积缩小一半 |
| C.压强不变,充入氮气使容器体积增大 |
| D.体积不变,充入水蒸气使容器压强增大 |
某生成物B的浓度为0.4mol/L , 经4s后浓度为2.0 mol/L , 则这4s内用B来表示该反应的化学反应速率为
| A.0.50 mol/(L·s) | B.0.20 mol/(L·s) |
| C.0.30 mol/(L·s) | D.0.40 mol/(L·s) |
Ⅰ.可逆反应:A(g)+3B(g) 2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
(1)这时B的浓度为________mol/L,C的浓度为________mol/L。
(2)这段时间内反应的平均速率若以D的浓度变化来表示,应为________mol/(L·min)。
(3)如果保持容器内温度不变,反应前和反应后容器内压强之比为_____(最简整数比)。
Ⅱ.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。请回答以下问题: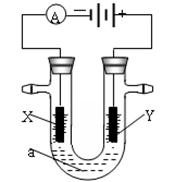
(4)在X极附近观察到的实验现象是:放出气体且______________。检验Y电极反应产物的方法是:把__________________放在Y电极附近,试纸变蓝色。
(5)当通过电解池通过1 mol电子时,两极共收集到________L气体(标准状况),电解池内的液体稀释到500 mL时,NaOH溶液浓度为________mol/L。
在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是
①升高温度②增大压强③增大反应物浓度④将块状固体反应物磨成粉末
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
可逆反应A(g)+2B(g) C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是
C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A.v(A)=0.4mol/(L·min) B.v(B)=0.6 mol/(L·min)
C.v(C)=0.1 mol/(L·min) D.v(D)=0.4 mol/(L·min)
在室温下,同种规格的镁条分别与下列物质混合,化学反应速率较大的是
| A.0.25mol/L的盐酸10mL | B.0.2mol/L的硫酸25mL |
| C.0.1mol/L的硫酸30mL | D.0.3mol/L的盐酸8mL |
CO和NO都是汽车尾气里的有害物质,它们能缓慢起反应生成N2和CO2。对此反应,下列叙述中正确的是( )
| A.使用催化剂不能改变反应速率 |
| B.降低压强能加快反应速率 |
| C.升高温度能加快反应速率 |
| D.改变压强对反应速率无影响 |
关于2SO2(g)+O2(g) 2SO3(g),下列叙述正确的是
2SO3(g),下列叙述正确的是

A.催化剂不改变该反应的逆反应速率 |
B.在平衡体系中增大SO2的浓度,重新达到平衡后,SO3的含量一定会增大 |
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为 |
(14分) 对于反应A(g) 2B(g) DH>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。回答下列各题。
2B(g) DH>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。回答下列各题。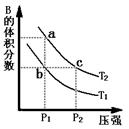
(1)根据曲线图,分析下列说法正确的是 ▲ (填字母) 。
A.a、c两点的反应速率:a 〉c
B.由状态b到状态a,可以通过加热的方法
C.b、c两点A气体的转化率相等
(2)上述反应在密闭容器(定容)中进行,达到平衡状态的标志是 ▲ (填字母) 。
A.单位时间内生成n mol A的同时分解2n molB
B.两种气体的体积分数不再改变
C.v正(A)=2v逆(B)
D.混合气体的密度不再发生变化
E.混合气体的压强不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1 mol·L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度 ▲ 0.1 mol·L-1(填“〉”、“〈”或“=”)。
(4)在100℃时,将0.40mol的B气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(B)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(A)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
① 在上述条件下,从反应开始至40s时,以A气体表示的该反应的平均反应速率为 ▲ ;
② 上表中n3 ▲ n4(填“〉”、“〈”或“=”),反应A(g) 2B(g)在100℃时的平衡常数K的值为 ▲ ,升高温度后,反应2B(g)
2B(g)在100℃时的平衡常数K的值为 ▲ ,升高温度后,反应2B(g)  A(g)的平衡常数K的值 ▲ (填“增大”、“减小”或“不变”);
A(g)的平衡常数K的值 ▲ (填“增大”、“减小”或“不变”);
③ 若在相同情况下最初向该容器中充入的是A气体,要达到上述同样的平衡状态,A气体的起始浓度为 ▲ mol·L-1。