关于化学反应与能量的说法正确的是( )
| A.根据右图提供的信息,该反应是放热反应 |
| B.化学变化中的能量变化主要由化学键变化引起的 |
| C.化学反应中只伴随热量的变化 |
| D.CaCO3(s)==CaO(s)+CO2(g) ΔH="+178.5" KJ·mol-1的意义是表示1mol CaCO3完全分解生成1mol CaO和1mol CO2气体要放出178.5 KJ的热量 |
下列说法或表示方法中正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.吸热反应发生过程中要不断从外界获得能量,放热反应一定不需要吸收外界能量 |
| C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O (l)ΔH= +285.8kJ/mol |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l)ΔH=" —53.7kJ/mol" ,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7kJ |
硫单质有两种常见的同素异形体:单斜硫和正交硫。已知常温常压下: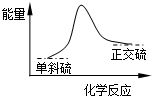
① S (s,单斜)+O2 (g)→SO2 (g)+297.16kJ;
② S (s,正交)+O2 (g)→SO2 (g)+296.83kJ
下列说法正确的是
| A.常温常压下单斜硫比正交硫稳定 |
| B.单斜硫转变为正交硫的能量变化可用右图表示 |
| C.S(g)+O2(g)→SO2(g)+Q3 Q3>296.83kJ |
| D.反应①中生成1 L SO2 (g)放出297.16kJ热量 |
对下列实验现象的原因分析不正确的一项是 ( )
| 选项 |
实验现象 |
原因分析 |
| A |
浓硫化钠溶液有臭味 |
硫 硫离子水解生成硫化氢,硫化氢具有臭味 |
| B |
新新制氯水中滴加石蕊试液,溶液先变红,后褪色 |
氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 |
| C |
SO 2通入溴水中,溴水褪色 |
SO 2具有漂白性,使其褪色 |
| D |
向向饱和Na2CO3溶液中通入足量CO2气体,溶液变浑浊 |
析析出了NaHCO3晶体 |
关于下列图示的说法中正确的是 
| A.用图 ① 所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图 ② 所示实验装置可以测定中和热 |
C.图 ③ 表示反应“CO(g)+H2O(g) CO2(g)+H2(g)”为将热能转化为化学能 CO2(g)+H2(g)”为将热能转化为化学能 |
| D.图 ④ 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
用化学方程式解释下列问题:
(1)盛放烧碱液的试剂瓶不能用玻璃塞_____________________________________________
(2)用NaOH溶液除去铝表面的保护层__________________________________
(3)制备氢氧化亚铁需隔绝空气___________________________________________________
(4)从氧化还原反应的角度看,在制备H2、CO2、Cl2三种气体时,盐酸作还原剂 。
(5)6种物质:N2O、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O可以组成一个已配平的化学方程式:___________________________________________。
下列叙述正确的是
| A.汽油、柴油和植物油都是碳氢化合物 |
| B.乙醇可以被氧化为乙酸,二者都能发生酯化反应 |
| C.甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| D.含5个碳原子的有机物,每个分子中最多可形成4个C-C单键 |
在一定条件下,可逆反应A(g)+B(g) mC(g);变化如下图所示。已知坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC(g);变化如下图所示。已知坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
⑴T1 T2(填“大于”、“等于”或“小于”。
⑵正反应是 反应(填“吸热”或“放热”),m 2(填“大于”、“等于”或“小于”)。
⑶某温度下,反应物的起始浓度分别为:c(A)="1" mo1/L,c(B)=" 2.4" mo1/L;达到平衡后,A的转化率为0.60,此时B的转化率为 。
下列说法正确的是
| A.凡是放热反应都是自发的,吸热反应都是非自发的 |
| B.某反应ΔH=-122KJ·mol-1,ΔS=231J·mol-1·k -1,此反应任何温度下都不能自发进行 |
| C.活化分子之间发生的碰撞不一定为有效碰撞 |
| D.对有气体参加的化学反应,减小体积增大体系压强,可使单位体积内活化分子数增加,因而反应速率增大 |
已知反应:
①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
②H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol 下列结论正确的是
| A.碳的燃烧热大于110.5kJ/mol |
| B.①的反应热为221kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
已知25 ℃、101 kPa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 moL C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 moL C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是
| A.金刚石比石墨稳定 | B.石墨转化为金刚石是物理变化 |
| C.石墨的能量比金刚石的能量高 | D.由石墨制备金刚石一定是吸热反应 |
下列说法不正确的是( )
| A.电解水生成氢气与氧气时,电能转变成化学能 | B.煤燃烧时化学能转变成热能等 |
| C.绿色植物光合作用是间接地把太阳能转变成化学能 | D.白炽灯工作时电能转化成光能和热能 |
下列说法不正确的是
| A.热化学方程式需注明物质的状态 |
| B.能源是能提供能量的资源 |
| C.化石燃料取之不尽,用之不竭 |
| D.反应热包括燃烧热、中和热等 |