某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种。向该溶液加入溴水后,溴被还原,由此推断该溶液中
| A.不含NO3-,也不含Fe3+ | B.含有NO3-、I-、Cl- |
| C.含I-,不含Cl- | D.含有Fe3+ |
SO2通入足量Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程中,下列说法中不正确的是
| A.上述过程中,最终被还原的是NO3— |
| B.从上述过程中可以得出结论,氧化性:HNO3>Fe3+>稀H2SO4 |
| C.假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为1∶1 |
| D.上述过程中,会产生一种无色无味的难溶于水的气体 |
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是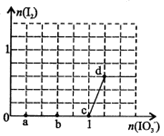
| A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素 |
| B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O |
| C.c点到d点的反应中共转移0.6mol电子 |
| D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O |
下述根据下列操作和现象,所得结论正确的是
| |
实验操作及现象 |
实验结论 |
| A |
分别向2 mL 0.1 mol·L-1 CH3COOH溶液和2 mL 0.1 mol·L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 |
酸性: CH3COOH > H2CO3> H3BO3 |
| B |
向浓度均为0.1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀 |
溶度积: Ksp(AgCl)<Ksp(AgI) |
| C |
向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去 |
证明生成了乙烯 |
| D |
将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色 |
氧化性:Br2>I2 |
有一种酸性溶液中存在NO3—、I—、Cl—、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中
| A.一定含有I—,不能确定是否有Cl— |
| B.一定含有NO3— |
| C.可能含有Fe3+ |
| D.一定含有I-、NO3—和Cl— |
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。则下列有关说法中不正确的
| A.还原性:I- >Fe2+ >Br- |
| B.原混合溶液中FeBr2的物质的量为6mol |
| C.当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
已知反应①2BrO3-+ Cl2=Br2 +2ClO3- ;②5Cl2 + I2 +6H2O=2HIO3 +10HCl ③ClO3-+5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是
| A.Cl2>BrO3->ClO3->IO3- | B.BrO3- >Cl2>ClO3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.ClO3->BrO3->IO3->Cl2 |
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4 +16HCl(浓) 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
(1)用单线桥法标出电子转移的方向和数目。
(2)该反应中的氧化剂与还原剂物质的量之比是 。
(3)KMnO4的氧化性比Cl2的氧化性 (选填“强”或“弱”)。
(4)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为 L。
(5)某同学欲用KMnO4固体配制100 mL0.5mol.L-1的溶液。回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、 、 。
②应用托盘天平称取KMnO4固体 g。
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号) 。
| A.加水定容时俯视刻度线 |
| B.容量瓶内壁附有水珠而未干燥处理 |
| C.颠倒摇匀后发现凹液面低于刻度线又加水补上 |
| D.在溶解过程中有少量液体溅出烧杯外 |
已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3 +6HCl=3Cl2+KCl +3H2O,③2KBrO3 +Cl2=Br2 + 2KClO3,
下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| C.反应②中还原剂与氧化剂的物质的量之比为6:1 |
| D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeC13溶液 ③Zn与H2SO4溶液 ④Fe与HC1溶液,由于浓度不同而能发生不同氧化还原反应的是
| A.①③ | B.③④ | C.①② | D.①③④ |
酸性溶液中粒子还原性顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应中不能实现的是
| A.2Fe3++SO2+2H2O =2Fe2++SO42-+4H+ | B.I2+SO2+2H2O =H2SO4+2HI |
| C.H2O2+H2SO4=SO2+O2+2H2O | D.2Fe3++2I- =2Fe2++I2 |
根据下列化学反应所得出的结论不正确的是
| |
化学反应 |
结 论 |
| A |
4HNO3 4NO2↑+O2↑+2H2O 4NO2↑+O2↑+2H2O |
HNO3保存在棕色瓶中,放在阴凉处 |
| B |
Ba2++SO42‾=BaSO4↓ |
加入BaCl2产生白色沉淀,再加入稀硝酸沉淀不溶解,溶液一定含有SO42‾ |
| C |
Al2O3+ 6H+=2Al3+ + 3H2O Al2O3+ 2OH-+3H2O=2[Al(OH)4]‾ |
Al2O3是两性氧化物 |
| D |
Br2+2Fe2+=2Br‾+2Fe3+ 2Fe3++2I‾=I2+2Fe2+ |
氧化性:Br2 > Fe3+ > I2 |
以下对氧化还原关系认识错误的是
| A.物质所含元素化合价降低的反应叫还原反应 |
| B.金属阳离子在氧化还原反应中一定作氧化剂 |
| C.含非金属元素的离子,在氧化还原反应中不一定作还原剂 |
| D.非金属原子越容易得到电子,其单质氧化性越强 |
常温下,在溶液中可发生以下反应:①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2;下列说法错误的是
| A.铁元素在反应①和③中均被氧化 |
| B.反应②中当有1mol Cl2被还原时,有2mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2>Br2>Fe3+>I2 |
| D.还原性强弱顺序为:I->Fe2+>Br->Cl- |