盖斯定律和中和反应原理在生产和科学研究中有很重要的意义。
(1)已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l) △H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=__________。
(2)用O2将HCl转化为Cl2,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现

其中,反应①的热化学反应方程式为:2HCl(g)+ CuO(s) H2O(g)+CuCl2(s) △H1
H2O(g)+CuCl2(s) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为_________________(反应热用△H1和△H2表示)。
(3)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,则两溶液的pH的关系式为x+y=________(填表达式)。

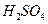 B.无水硫酸铜粉 C.无水氯化钙颗粒
B.无水硫酸铜粉 C.无水氯化钙颗粒
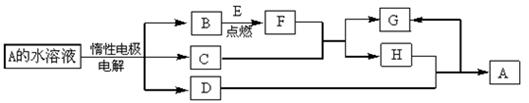
 液反应,其化学式为_▲_。
液反应,其化学式为_▲_。 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。 验现象是 ,反应的化学方程式为 ;
验现象是 ,反应的化学方程式为 ; 粤公网安备 44130202000953号
粤公网安备 44130202000953号