(1)某同学用大头针、三角板、量角器等器材测半圆形玻璃砖的折射率.开始玻璃砖的位置如右图中实线所示,使大头针P1、P2与圆心O在同一直线上,该直线垂直于玻璃砖的直径边,然后使玻璃砖绕圆心O缓慢转动,同时在玻璃砖的直径边一侧观察P1、P2的像,且P2的像挡住P1的像.如此观察,当观察到玻璃砖转到右图中虚线位置时,上述现象恰好消失.此时只需测量出,即可计算出玻璃砖的折射率.请用你的测量量表示出折射率n= .

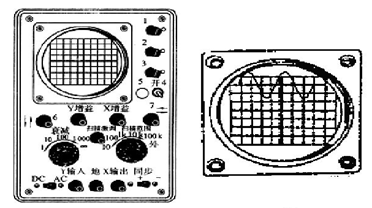
(2)经过正确调节在示波器屏上显示如图所示波形,要将波形移到坐标中心,应调节面板上的 旋钮;要使此波形横向展宽,应调节 旋钮;要使屏上只显示出1个完整的波形,应调节 旋钮.