[化学——选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为____ ,该能层具有的原子轨道数为____ 、电子数为 。
(2)硅主要以硅酸盐、____ 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献____ 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4C1在液氨介质中反应制得SiH4,该反应的化学方程式为___ 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是____ 。
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 。Si与O的原子数之比为 。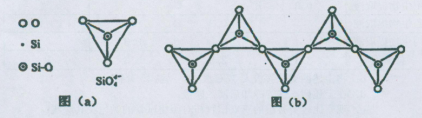




 及
及 结构)有种。
结构)有种。
 2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。
2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。 (5).增大容器的体积, v正 v逆
(5).增大容器的体积, v正 v逆  粤公网安备 44130202000953号
粤公网安备 44130202000953号