(共11分)实验室制备1,2—二溴乙烷的反应原理如下:

可能存在的的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用16.0g的溴和足量的乙醇制备1,2—二溴乙烷,实验结束后得到9.4g产品。实验装置如下图所示:

有关数据列表如下:
|
乙醇
|
1,2—二溴乙烷
|
乙醚
|
状态
|
无色液体
|
无色液体
|
无色液体
|
密度 / g·cm-3
|
0.79
|
2.2
|
0.71
|
沸点 / 0C
|
78.5
|
132
|
34.6
|
熔点 / 0C
|
-130
|
9
|
-116
|
溶解性
|
易溶水
|
难溶水
|
微溶于水
|
请回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是 (填正确选项前的字母);
a、引发反应 b、加快反应速度
c、防止乙醇挥发 d、减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a、水 b、浓硫酸 c、氢氧化钠溶液 d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是 。
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是 ;
(6)反应过程中应用冷水冷却装置D,其主要目的是 ,但又不能过度冷却(如用冰水),其原因是 ;
(7)本实验中,1,2—二溴乙烷的产率为 。



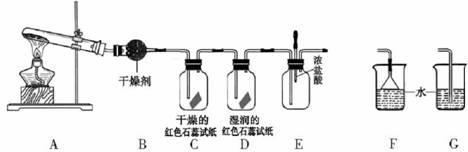
 CuSO4 + SO2↑+ 2H2O,某课外活动小组设计了如图所示实验装置,进行铜与浓硫酸的反应。
CuSO4 + SO2↑+ 2H2O,某课外活动小组设计了如图所示实验装置,进行铜与浓硫酸的反应。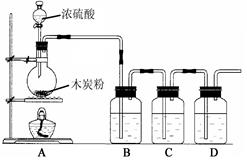

 mL =" 20.02" mL
mL =" 20.02" mL

 粤公网安备 44130202000953号
粤公网安备 44130202000953号