某研究性学习小组用FeCl3溶液做“腐蚀液”,制作印刷电路板,其反应原理是:2FeCl3+Cu=2FeCl2+CuCl2。
【实验探究】
(1)通过《化学1》的学习,知道了有离子参加的化学反应为离子反应。离子反应可用离子方程式表示。请写出2FeCl3+Cu=2FeCl2+CuCl2反应的离子方程式为: 。
(2)若要溶解电路板上3.2g的铜,则至少需要FeCl3物质的量为 mol。
(3)使用后失效的“腐蚀液”为废液,验证废液中是否存在Fe3+的试剂是 ,加入该试剂后,若出现 现象,说明废液中还存在Fe3+。
(4)废液中的CuCl2可通过加入足量的 ,反应后转化成铜且能使所得溶液中含有单一溶质。
(5)回收Cu后的废液,通入足量的Cl2,可以重新获得FeCl3溶液,其反应的化学方程式为 。
【实验结论】
利用FeCl3溶液做印刷电路板的“腐蚀液”,不仅废液中的铜可以得到回收,经过处理后的废液还可以重新使用。
【知识拓展】
(6)铁元素是维持生命活动不可缺少的微量元素,虽然人体中通常只含有3~5g铁元素,但铁元素在人体中却发挥着重要作用,人体缺铁会引起 疾病。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
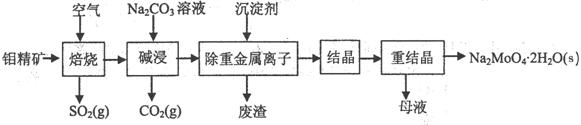 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________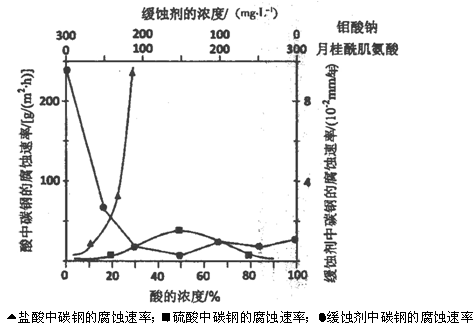
 Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。 物质
物质
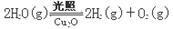 ΔH >0
ΔH >0 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。

 与1分子
与1分子 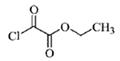 也可以发生类似反
也可以发生类似反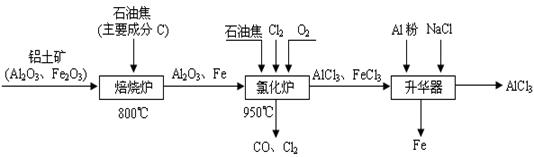
 HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题: