将橡皮筋的一端固定在A点,另一端拴上两根细绳,每根细绳分别连着一个量程为5N、最小刻度为 0.1 N的弹簧测力计甲和乙,沿着两个不同的方向拉弹簧测力计, 当橡皮筋的活动端拉到 O点时, 两根细绳相互垂直,如图所示, 这时弹簧测力计的读数可从图中读出。
(l)由图可读得甲和乙两个相互垂直的拉力的大小分别为________N和_______N。(只须读到 0.1N)
(2) 在本题的虚线方格纸上按作图法的要求画出这两个力及它们的合力。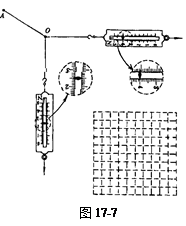
将橡皮筋的一端固定在A点,另一端拴上两根细绳,每根细绳分别连着一个量程为5N、最小刻度为 0.1 N的弹簧测力计甲和乙,沿着两个不同的方向拉弹簧测力计, 当橡皮筋的活动端拉到 O点时, 两根细绳相互垂直,如图所示, 这时弹簧测力计的读数可从图中读出。
(l)由图可读得甲和乙两个相互垂直的拉力的大小分别为________N和_______N。(只须读到 0.1N)
(2) 在本题的虚线方格纸上按作图法的要求画出这两个力及它们的合力。