空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):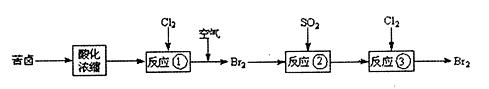
(1)反应①的离子方程式为 。
(2)反应②中的还原剂是 。
(3)实验室从反应③后的溶液中分离出单质溴的方法是 、 、蒸馏。
(4)苦卤还可以用来制取金属镁,用化学方程式或离子方程式表示从苦卤制取金属镁的反应原理
空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
(1)反应①的离子方程式为 。
(2)反应②中的还原剂是 。
(3)实验室从反应③后的溶液中分离出单质溴的方法是 、 、蒸馏。
(4)苦卤还可以用来制取金属镁,用化学方程式或离子方程式表示从苦卤制取金属镁的反应原理