海带中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:(已知:Cl2 + 2KI =" 2KCl" + I2)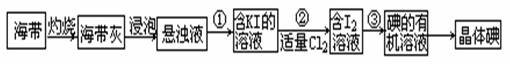
(1)提取碘的流程中:步骤①需要的主要仪器是 ,步骤③需要的主要仪器是 (填序号)
(2)写出步骤②中涉及的有关离子反应方程式 。
(3)提取碘的过程中,可供选择的有机试剂有 。
| A.四氯化碳 | B.醋酸 | C.酒精 | D.苯 |
海带中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:(已知:Cl2 + 2KI =" 2KCl" + I2)
(1)提取碘的流程中:步骤①需要的主要仪器是 ,步骤③需要的主要仪器是 (填序号)
(2)写出步骤②中涉及的有关离子反应方程式 。
(3)提取碘的过程中,可供选择的有机试剂有 。
| A.四氯化碳 | B.醋酸 | C.酒精 | D.苯 |