利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+O2(g)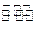 2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正) v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正) v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。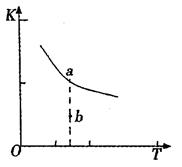
(2)若反应物起始的物质的量相同,下列关系图不正确的是 (填序号)。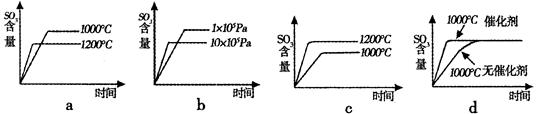
(3)某硫酸厂利用SO2尾气、废铁屑、空气、水合成绿矾(FeS04·7H2O),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到(NH4)2SO3和(NH4)2SO4两种化工原料。
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO2-3)十c(HSO-3)+c(H2SO3)]=c(NH+4)+c(NH3·H2O)
请分析该同学的依据是 。
②在(NH4)2 SO4溶液中存在:NH+4+ H2O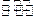 NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数K=1.
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数K=1. 7×10-
7×10- 5)
5)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强 (pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO4,应尽快用大量0. 5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(已知25℃时,Ksp(BaSO4)=1×l0-10 ,Ksp
(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO4,应尽快用大量0. 5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(已知25℃时,Ksp(BaSO4)=1×l0-10 ,Ksp (BaCO3)=1×10-9).
(BaCO3)=1×10-9).

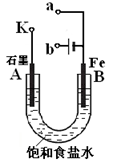
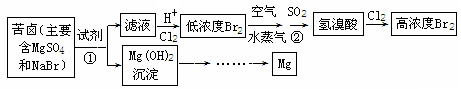
 MgO
MgO  Mg
Mg Mg
Mg 无水MgCl2
无水MgCl2 Mg
Mg MgCl2(溶液)
MgCl2(溶液) Mg
Mg
 粤公网安备 44130202000953号
粤公网安备 44130202000953号