(1)右图中游标卡尺读数为 cm。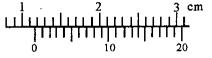
(2)在“用单摆测重力加速度”的实验中。某同学的操作步骤为:
a.取一根细线,下端系住直径为d的金属小球,上端固定在铁架台上
b.用米尺量得细线长度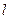
c.在细线偏离竖直方向5°位置释放小球
d.用秒表记录小球完成n次全振动所用的总时间t,得到周期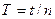
e.用公式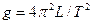 计算重力加速度
计算重力加速度
按上述方法得出盼重力加速度值与实际值相比 (选填“偏大”、“相同”或“偏小”)。
(1)右图中游标卡尺读数为 cm。
(2)在“用单摆测重力加速度”的实验中。某同学的操作步骤为:
a.取一根细线,下端系住直径为d的金属小球,上端固定在铁架台上
b.用米尺量得细线长度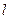
c.在细线偏离竖直方向5°位置释放小球
d.用秒表记录小球完成n次全振动所用的总时间t,得到周期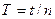
e.用公式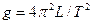 计算重力加速度
计算重力加速度
按上述方法得出盼重力加速度值与实际值相比 (选填“偏大”、“相同”或“偏小”)。