河南省郑州二外上学期高一期中考试化学试卷
下列说法错误的是( )
| A.假说经过反复验证和修正,才发展成为科学的理论 |
| B.模型一般可分为物体模型和思维模型 |
| C.研究物质的性质常用观察、实验、分类、比较等方法 |
| D.科学实验能解决化学学科的所有问题 |
在物质分类中,前者包括后者的是( )
| A.氧化物、化合物 | B.化合物、电解质 | C.溶液、 胶体 | D.溶液、 分散系 |
将30 mL 0.5mol/LNaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为( )
| A.0.3 mol/L | B.0.03 mol/L | C.0.05 mol/L | D.0.04 mol/L |
下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是( )
| A.置换反应一定是氧化还原反应 |
| B.分解反应一定不是氧化还原反应 |
| C.化合反应一定是氧化还原反应 |
| D.复分解反应不一定是氧化还原反应 |
潮湿的氯气、新制的氯水、次氯酸钠溶液、漂白粉溶液均能使有色布条褪色,这是由于它们含有或能生成( )
| A.氯气 | B.次氯酸 | C.次氯酸根 | D.氯化氢 |
下列各组物质相互混合后,不会发生离子反应的是( )
| A.Na2SO4溶液和MgCl2溶液 | B.Na2CO3溶液和稀硫酸 |
| C.NaOH溶液和FeCl3溶液 | D.Ca(OH)2和盐酸 |
2.2 g化合物A含有3.01×1022个A分子,则A的相对分子质量为( )
| A.11 | B.22 | C.44 | D.44 g/mol |
下列反应属于氧化还原反应的是( )
| A.CaCO3+2HCl=CaCl2+H2O+CO2↑ |
| B.SO2+H2O=H2SO3 |
| C.Cl2+2NaOH=NaCl+NaClO+H2O |
| D.NaBr+AgNO3=AgBr↓+NaNO3 |
下列物质在水溶液中的电离方程式书写正确的是( )
| A.CaCl2=Ca2++2Cl- | B.K2CO3=K2++CO32- |
| C.Ba(OH)2=Ba 2++(OH)2- | D.FeCl3=Fe2++3Cl- |
胶体分散系与其它分散系的本质区别是( )
| A.分散质直径大小 | B.是否有丁达尔现象 |
| C.是否稳定 | D.分散质粒子是否带电 |
现有①液态氧 ②氢氧化铁胶体 ③食盐水 ④纯碱 ⑤氢氧化钾 ⑥空气 对上述物质的分类全部正确的是( )
| A.盐——③④ | B.纯净物——④⑤⑥ |
| C.碱——④⑤ | D.混合物——②③⑥ |
下列离子方程式与化学反应事实一致的是( )
| A.硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
| B.石灰石溶于盐酸:CO32-+2H+=H2O+CO2↑ |
| C.硫酸溶液与氢氧化钾溶液反应:H++OH-=H2O |
| D.Cu和AgNO3溶液反应:Cu+Ag+=Cu2++Ag |
和22 g CO2所含分子数相等的水的质量为( )
| A.44 g | B.22 g | C.18 g | D.9 g |
下列有关0.1 mol/LNaOH溶液的叙述正确的是( )
| A.该溶液中含有NaOH4g |
| B.100ml该溶液中含有Na+ 0.01mol |
| C.从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol/L |
| D.在1L水中溶解4g NaOH即可配制得0.1 mol/L NaOH溶液 |
在100mL的溶液中溶有0.1molNaCl和0.1molMgCl2,此溶液中Cl-的物质的量浓度为( )
| A.3mol/L | B.2 mol/L | C.0.3 mol/L | D.0.2 mol/L |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A.标准状况下,1mol H2O的体积约为22.4L |
| B.1 L 1mol/L Na2CO3溶液中Na+的物质的量为1mol |
| C.NA个氢气分子所占的体积为22.4L |
| D.常温常压下NA个二氧化碳分子的质量为44g |
7.2g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
| A.2.1g | B.3.6g | C.7.2g | D.不可求 |
下列各组中的离子,能在溶液中大量共存的是( )
| A.K+、H+、SO42-、OH- | B.Na+、Ca2+、CO32-、NO3- |
| C.Na+、H+、Cl-、CO32- | D.Na+、Cu2+、SO42-、Cl- |
根据以下几个反应:
①Cl2+2KBr=2KCl+Br2 ②Br2+2KI=2KBr+I2 判断氧化性由强到弱的顺序是( )
| A.I2>Br2>Cl2 | B.Cl2>Br2>I2 | C.Br2>I2>Cl2 | D.Cl2>I2>Br2 |
(6分)、写出下列反应的化学方程式:
(1)过氧化钠和水反应
(2)写出钠放入FeCl3溶液中
(3)制取漂白粉
(7分)已知:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,用双线桥法标出上述电子转移的方向和数目:__ _。上述反应中还原剂是________;氧化剂是_______。
将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:_________________________________。B组:_________________________________。
有一包白色固体,可能是NaCl、K2CO3、Na2SO4和BaCl2中的一种或几种。将此白色固体溶解于水时,有白色沉淀生成,过滤后,滤液为无色。
①将部分沉淀移入试管中,加入稀硝酸,沉淀完全溶解,且有气体生成。
②在滤液中滴入几滴AgNO3溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
(1)通过上述实验现象分析:该白色固体中一定含有的物质为_______,不可能含有的物质为_______。
(2)试写出有关反应的离子方程式:
①______________________________;②______________________________;
③______________________________。
实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是_____ _____。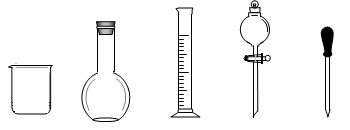
A B C D E
(2)在容量瓶的使用方法中,下列操作不正确的是____________
| A.使用容量瓶前检验是否漏水 |
| B.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| C.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。 |
(3)根据计算用托盘天平称取的质量为 g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL(保留1位小数),如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。
(5)配制硫酸溶液过程中,下列操作会引起结果偏高的是 (填序号)
①未洗涤烧杯、玻璃棒
②未冷却至室温就转移到容量瓶定容
③容量瓶不干燥,含有少量蒸馏水
 粤公网安备 44130202000953号
粤公网安备 44130202000953号