内蒙古赤峰市高三上学期9月质量检测化学试卷
化学已经渗透到人类生活的各个方面,下列说法不正确的是
| A.食盐可作氯碱工业的原料 |
| B.碘酒是指单质碘的乙醇溶液 |
| C.大量使用化肥和农药,以提高农作物产量,符合绿色化学的原则 |
| D.低碳生活注重节能减排,尽量使用太阳能灯代替化石燃料,减少温室气体的排放 |
下列化学用语表达不正确的是
A.次氯酸的电子式: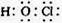 |
B.质子数为6、质量数为14的原子: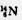 |
C.CS2的结构式: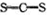 |
D.氯的原子结构示意图: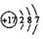 |
橄榄石型LiFePO4是一种锂离子电池正极材料,下列有关LiFePO4的说法中不正确的是
| A.LiFePO4中铁元素的化合价为+2价 | B.LiFePO4中Li、P、O均属于短周期元素 |
| C.LiFePO4能与稀硫酸发生氧化还原反应 | D.LiFePO4中Li、Fe、P均属于主族元素 |
下列物质中既存在共价键又离子键的是
| A.Na2O2 | B.MgCl2 | C.SiO2 | D.H2SO4 |
用 NA表示阿伏伽德罗常数的数值,下列叙述正确的是
| A.常温下,1 mol丙烯中含碳原子数为3 NA |
| B.常温下,pH=13的NaOH溶液中含OH¯数为NA |
| C.标准状况下,22.4L CHCl3中含C-H键数为NA |
| D.23g Na与足量氧气反应时转移的电子数为2 NA |
常温下在下列给定的溶液中,能大量共存的粒子组是
| A.能使pH试纸呈红色的溶液: CH3COOH、NH4+、I-、NO3- |
| B.加入铝粉生成H2的溶液:K+、Mg2+、 SO42-、HCO3- |
| C.c(Fe2+)=0.1mol/L的溶液:H+、Al3+、Cl-、SCN- |
| D.pH=14的溶液:Na+、NH3·H2O、NO3-、SiO32- |
柠檬烯醇是一种食用香精,其结构简式如图所示。下列有关柠檬烯醇的说法正确的是
| A.能与氢氧化钠溶液发生中和反应 |
| B.能发生加成反应和取代反应 |
| C.不能使酸性高锰酸钾溶液褪色 |
D.与对丙基苯甲醇 互为同分异构体 互为同分异构体 |
在酸性介质中,向MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生如下离子反应: ,下列说法正确的是:
,下列说法正确的是:
| A.X是 H2O |
| B.还原性:SO42->Mn2+ |
| C.该反应中酸性介质可以为盐酸 |
| D.每生成0.1 molSO42-转移电子0.05 mol |
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
| A.充电时电极a为电源的负极 |
| B.放电时负极的电极反应式为 Zn+2e-=Zn2+ |
| C.放电时左侧的电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止 Br2和Zn 直接发生反应 |
实验室某些物质的制备装置如图所示(省略夹持装置和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的是

短周期主族元素X、Y、Z、W在元素周期表中的位置关系如图,下列推论合理的是
| A.若Z的核电荷数是Y的两倍,则X为碳元素 |
| B.若W的核电荷数是Y的两倍,则X是氮元素 |
| C.原子半径:Z>Y>X |
| D.最简单氢化物的稳定性:Y>X>W |
向某恒容密闭容器中充入一定量CO2和H2,发生反应: ,测
,测
得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示,下列物理量中,a点大于b点的是
| A.正反应速率 |
| B.逆反应速率 |
| C.HCOOH(g)的浓度 |
| D.H2的体积分数 |
下列溶液中,微粒浓度关系正确的是
| A.常温下,pH=6的醋酸与醋酸钠组成的混合溶液中:c(Na+)>c(CH3COO-) |
| B.将Cl2通入过量KOH溶液中:(ClO-)+c(Cl-)=c(K+) |
| C.0.1 mol/L的Na2S溶液中:c(OH-)= c(H+)+ c(HS-)+2 c(H2S); |
| D.室温下,pH=2的盐酸与PH=12的氨水等体积混合,所得溶液中:c(Cl-)> c(H+)> c(NH4+)> c(OH-) |
某工厂用硫酸处理氨气尾气,得到铵盐(不同批次得到a、b、c三种不同的铵盐)。称取不同质量的铵盐,加入到固定量的NaOH溶液中并加热,收集氨气,得到如下生成氨气的量与加入铵盐的量的关系图: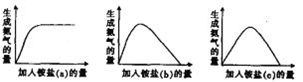
下列判断不正确的是:
| A.a对应的铵盐是(NH4)2SO4 |
| B.b对应的铵盐是(NH4)2SO4和NH4HSO4 |
| C.c对应的铵盐是NH4HSO4 |
| D.当b和c铵盐的质量相同时,可得到相同质量的氨气 |
硫、氯及其化合物有广泛的用途。
(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒的物质。CN-被氧化后的产物为 (填化学式)。
(2)“氯胺(NH2Cl)消毒法“是在用液氯处理自来水的同时通入少量的氨气,发生反应:
 ,生成 的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。氨氯能用于消毒杀菌的原因是 (用化学方程式表示)。
,生成 的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。氨氯能用于消毒杀菌的原因是 (用化学方程式表示)。
(3)如图所示装置和药品可用来制备 。
。
① 三种酸的酸性由强到弱的顺序位 。
三种酸的酸性由强到弱的顺序位 。
②配平广口瓶中生成 反应的化学方程式:
反应的化学方程式:
1808年,英国化学家用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁作为一种强还原剂,还用于钛、铍和铀的生产中。
(1)镁在元素周期表中的位置为 。
(2)写出用镁与金红石(主要成分为TiO2)在加热条件下制取钛的化学方程式:
。
(3)镁在加热的条件下还能与NaOH固体反应,生成MgO和单质X、单质Y。已知X与水反应可生成单质Y,则镁与NaOH反应的化学方程式为: 。
(4)镁一过氧化氢电池的工作原理如图所示,该电池放电时总反应的化
学方程式为: 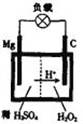
氮的氧化物对人体危害极大,实验时应防止其对空气的污染。
实验一:某同学利用下列装置实现铜与浓硝酸、稀硝酸的反应。
Ⅰ、取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ、将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅲ、按如图所示装置连接仪器、检查气密性、装入化学试剂。
(1)请完成过程Ⅰ发生反应的离子方程式:
Cu2(OH)2CO3+4H+= 。
(2)过程Ⅲ的后续操作如下:
① 为使浓硝酸与铜丝接触,操作是打开止水夹a和b, ,当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器。生成红棕色气体的化学方程式是 。
② 控制b与分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见有无色气体产生。稀硝酸充满玻璃管的目的是 。
实验二:NO2与水反应的实验研究。
(3)将3支充满红棕色气体的小试管分倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):
① 根据上表得出的结论是温度越 (填“高”或“低“),进入试管中的溶液越多。
② 查阅材料:a.NO2与水反应的实际过程为:2NO2+ H2O=HNO3+ HNO2,3 HNO2= HNO3+2NO↑+H2O;b. HNO2不稳定。则产生上述现象的原因是 。
甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:

(1)该反应的化学平衡常数表达式为K= 。
(2)该反应的正反应为 (填“放热”或“吸热”)反应。
(3)容器Ⅰ中的反应达到平衡时所需的时间 (填“大于”“小于”或“等于”) 容器Ⅱ中的
(4)a= ,b=
(5)已知下面两个反应(m、n均大于0):
反应①:
反应②:
则下列m与n的关系中,正确的是 (填字母)。
A n>2m B m>2n C n=m D m>3n
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含 等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫。
等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫。
(1) (填“能”或“不能”)用NaOH溶液代替H2SO4溶液。
(2)酸浸时反应的离子方程式为 。
(3)加CaCO3调节溶液的pH至3.6其目的是 。
(4)已知粉煤灰中Al2O3的质量分数为40.8%,制得的碱式硫酸铝[Al2(SO4)x(OH)6-2x]中x=1.5。某实验小组取80.0g粉煤灰进行上述实验,假设在整个过程中铝的损耗率为10%,则可制得碱式硫酸铝的质量为 。
(化学与技术)某硫酸厂以含有SO2的尾气、氨气等为原料,合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下: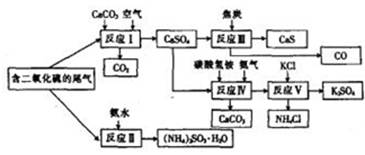
(1)写出反应Ⅲ的化学方程式: 。
(2)下列有关说法正确的是 (填字母)
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
| B.反应Ⅱ和反应Ⅲ的基本反应类型相同 |
C.反应Ⅳ需控制在60---70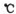 ,目的之一是减少碳酸氢铵的分解 ,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
(3)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式: 。
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气。
① 用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2,吸收液中的溶质为
。
② 某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00 mL,则酸性KMnO4,溶液中c(KMnO4) = 。
(5)氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。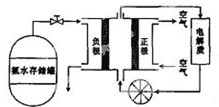
氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是 ,负极的电极反应式是
。
(物质结构与性质)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为: 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C (填“>”或“<”,下同)B;第一电离能:N O 。
(3)月球岩石——玄武岩的主要成分为钛硫酸亚铁 与80%的硫酸反应可生成
与80%的硫酸反应可生成 的空间构型为 形,其中硫原子采用 杂化。
的空间构型为 形,其中硫原子采用 杂化。
(4)磷酸肽 锂离子电池能来那个密度大、安全性高。
锂离子电池能来那个密度大、安全性高。 可由
可由 与
与 反应制得。两分子
反应制得。两分子 发生脱水生成焦磷酸:
发生脱水生成焦磷酸:
则三分子 脱去两分子
脱去两分子 生成三磷酸,其结构式为 ,四分子
生成三磷酸,其结构式为 ,四分子 脱去四分子
脱去四分子 生成的四偏磷酸属于 元酸。
生成的四偏磷酸属于 元酸。
(5)Ti的氧化物和CaO相互作用能形成太酸盐 的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围 个O2-紧邻。
的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围 个O2-紧邻。
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中
实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重
大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为 (x<1),若测得某
(x<1),若测得某 晶体密度为5.71g·cm-3,晶胞边长为4.28×
晶体密度为5.71g·cm-3,晶胞边长为4.28× m,则
m,则 中x= 。
中x= 。
(有机化学基础)蜂胶是一种天然抗癌药
物,一个五六万只的蜂群一年只能产100多克蜂胶,所
以蜂胶又被誉为“紫色黄金”。蜂胶的主要活性成分为
咖啡酸苯乙酯,其分子结构如下图所示(短线表示化学
键,如单键、双键等),在一定条件下能发生如下转化:

请回答下列问题:
(1)咖啡酸苯乙酯的分子式为 ,C结构简式为 。
(2)① A中含氧官能团的名称为 、 。
② A 可以发生的反应是 (填字母)
a 加成反应 b 酯化反应 c 消去反应 d 氧化反应
③ A 与甲醇反应生成B的化学方程式是 。
(3)高分子E的结构简式是 。
(4) 发生反应的反应类型是 。
发生反应的反应类型是 。
(5)B的同分异构体有很多种,其中同时符合下列条件的同分异构体的结构简式为 。
a 苯环上只有两个取代基 b 能发生银镜反应 c 能与氢氧化钠溶液反应
d 不能与氯化铁溶液发生显色反应 e 核磁共振氢谱图中有三组峰
 粤公网安备 44130202000953号
粤公网安备 44130202000953号