甘肃省嘉峪关市第二学期期末高一联合考试化学试卷
通常用来衡量一个国家的石油化学工业发展水平的标志是( )
| A.石油产量 | B.乙烯的产量 | C.合成纤维的产量 | D.硫酸的产量 |
在元素周期表中金属与非金属的分界处,可以找到( )
| A.合金 | B.半导体材料 | C.催化剂 | D.农药 |
可以用分液漏斗分离的一组混合物是( )
| A.酒精和碘 | B.苯和水 | C.乙酸和水 | D.溴和四氯化碳 |
下列反应中,光照对反应几乎没有影响的是( )
| A.氯气与氢气反应 | B.次氯酸分解 | C.甲烷与氯气反应 | D.甲烷与氧气反应 |
下列物质中,在一定条件下能发生取代反应和加成反应,但不能使酸性高锰酸钾溶液褪色的是
| A.乙烷 | B.甲烷 | C.苯 | D.乙烯 |
目前,医疗上使用放射性核素 治疗肿瘤,该核素原子核内的中子数与电子数之差是
治疗肿瘤,该核素原子核内的中子数与电子数之差是
| A.125 | B.72 | C.19 | D.53 |
汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是( )
| A.减小压强能增大反应速率 | B.增大压强能减小反应速率 |
| C.使用适当的催化剂能增大反应速率 | D.升高温度对反应速率无影响 |
在密闭容器中进行如下反应:I2(g)+H2(g)  2HI(g),已知I2、H2、HI的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
2HI(g),已知I2、H2、HI的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
| A.HI为0.4mol/L | B.H2为0.15mol/L | C.I2为0.2mol/L | D.HI为0.35mol/L |
书法离不开文房四宝(笔、墨、纸、砚),做笔用的狼毫,研墨用的墨条以及宣纸(即白纸)和做砚台用的砚石的主要成份依次是 ( )
| A.多糖、石墨、蛋白质、无机盐 | B.塑料、石墨、多糖、无机盐 |
| C.蛋白质、炭黑、多糖、无机盐 | D.蛋白质、煤炭、多糖、有机玻璃 |
在下图所示的原电池中,下列说法错误的是
| A.溶液的pH逐渐变小 | B.负极附近SO42-离子浓度逐渐增大 |
| C.正极有H2逸出 | D.正极质量无变化 |
下列各组离子在溶液中能大量共存的是
| A.H+、Fe2+、Cl-、 NO3- | B.Cl-、Ag+、NO3-、K+ |
| C.K+、Ba2+、NO3-、SO42- | D.K+、Cl-、Na+、SO42- |
可逆反应A(g)+ 4B(g) C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
| A.vA==0.15mol/(L·min) | B.vB="=0.6" mol/(L·min) |
| C.vC="=0.4" mol/(L·min) | D.vD="=0.01" mol/(L·s) |
下列金属冶炼的反应原理,错误的是
A.2NaCl(熔融) 2Na +Cl2↑ 2Na +Cl2↑ |
B.MgO+H2 Mg+ H2O Mg+ H2O |
C.Fe3O4+4CO  3 Fe +4 CO2 3 Fe +4 CO2 |
D.2 HgO 2 Hg+ O2↑ 2 Hg+ O2↑ |
下列叙述正确的是
| A.非金属原子间以共价键结合的物质一定是共价化合物 |
| B.含有共价键的化合物一定是共价化合物 |
| C.凡是能电离出离子的化合物一定是离子化合物 |
| D.凡是含有离子键的化合物一定是离子化合物 |
NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,22.4L苯的分子数约为NA个 |
| B.标准状况下,17g NH3所含共价键数为NA个 |
| C.常温下,在18g18O2中含有NA个氧原子 |
| D.1mol Na2O2中含有的阴离子数目为2NA个 |
下列各组物质的性质由强到弱的顺序排列正确的是
| A.酸性:HClO4>H3PO4>H2SO4 | B.氢化物稳定性:H2S>HF>H2O |
| C.碱性:NaOH>Al(OH)3>Mg(OH)2 | D.氧化性:F2 > Cl2 > Br2 > I2 |
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4,下列图中表示其产生H2总体积(V)与时间(t)的关系正确的是( ) 
电子数相等的微粒叫做等电子体,下列各组微粒属于等电子体是
| A.CO和CO2 | B.NO和CO | C.CH4和NH3 | D.OH- 和S2- |
下列有机物:①苯,②硝基苯,③溴苯,④CCl4四种物质中,在常温、常压下为无色且密度比水大的液体是
| A.①②③ | B.①③④ | C.②③④ | D.都是 |
根据下表中烃的分子式排列,判断空格中烃的同分异构体数目是
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| CH4 |
C2H4 |
C3H8 |
C4H8 |
|
C6H12 |
C7H16 |
C8H16 |
A.3 B. 4 C. 5 D. 6
已知乙烯能使酸性高锰酸钾溶液褪色,下列褪色原理与其一致的是( )
| A.SO2使品红溶液褪色 | B.乙烯使溴水褪色 |
| C.SO2使溴水褪色 | D.甲烷使氯气褪色 |
1mol下列物质(1)甲烷、(2)乙烯、(3)苯、(4)乙醇在足量氧气中充分燃烧,消耗氧气物质的量大小顺序正确的是
| A.(1)<(2)<(3)<(4) | B.(1)<(2)=(4)<(3) | C.(1)<(2)<(4)<(3) | D.(1)<(4)<(2)<(3) |
(1) 把除去氧化膜的铁丝投入到盛有稀硫酸的试管中,产生氢气 的速率变化情况如图所示图中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核 外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
①甲的单质与水反应的离子方程式为 ;②乙元素在周期表中的位置为 ;③丙元素的最高价氧化物的电子式为 ;④甲与丁两种元素可组成的具有强氧化性的物质是 。(填化学式)
(3)某元素R,它的最高价含氧酸的阴离子是RO4ˉ,则其气态氢化物的化学式是 。
现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。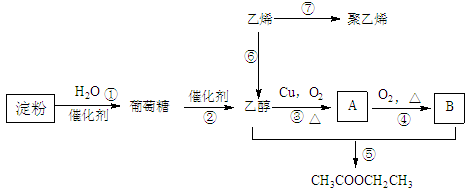
(已知:2CH3CHO+O2 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是 ;其中③的反应类型是 ;
⑥的反应类型是 ;
(2)写乙烯的电子式: 乙烯的结构简式:___________ ;
(3)写出下列反应的化学方程式:① _______________ ; ⑤ _______________________________。
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好实验装置,关闭活塞a、b、c,在铜网的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体。在M处观察到明显的实验现象。试回答以下问题:
(1)A中发生反应的化学方程式为 ;
B的作用是 ,C中热水的作用是_____________
(2)从M管中可观察到的现象是 ,请写出相应的化学反应方程式:_____________
(3)实验进行一段时间后,如果撤掉酒精灯,反应能继续进行,其原因是_________________。
在一固定容积的密闭容器中,a mol/LN2和b mol/L H2反应,一定条件下经过2min达到平衡,生成c mol/L NH3.
求:(1)用H2表示的速率是多少?(2)N2的转化率是多少?
 的一溴代物有( )
的一溴代物有( )



 粤公网安备 44130202000953号
粤公网安备 44130202000953号